ユビキチン・プロテアソーム系を利用する創薬手法

近年、注目を集める新しい創薬モダリティの一つにPROTAC(Proteolysis-Targeting Chimera)がある。国立医薬品食品衛生研究所の出水庸介氏は2010年からPROTACの研究を進め、創薬標的になりにくかった転写因子を標的とした「デコイ核酸型PROTAC」を開発するなど革新的な成果を生み出している。
PROTACは、細胞内のタンパク質分解機構であるユビキチン・プロテアソームシステム(UPS)を利用して標的となるタンパク質を分解することにより、薬理作用を発揮させる創薬手法である。
出水氏は「細胞内の不要または病原性タンパク質を標的として、UPSによる分解を人為的に誘導する創薬手法であるPROTACは、2001年にイエール大学のCraig M. Crews教授らによって初めて提唱された」と説明。さらに、「その後、技術的改良を経て、2010年代半ばから世界各国で本格的な研究と創薬応用が加速している」と話す。
2019年にはPROTAC医薬品で初の臨床試験が開始され、2025年1月時点で30品目以上が臨床試験に入っている。
UPSでは、3つのユビキチン合成酵素の連続反応によって標的タンパク質に付加されたユビキチン鎖を目印に、プロテアソームが認識して標的タンパク質を分解する。PROTACはユビキチン鎖合成の最終段階で働くE3リガーゼに対するリガンドと、標的タンパク質に対するリガンドをリンカーで結び付けた構造であり、それぞれのリガンドが標的タンパク質とE3リガーゼに結合し、両者が近接することで強制的にUPSを発動させる(図1)。
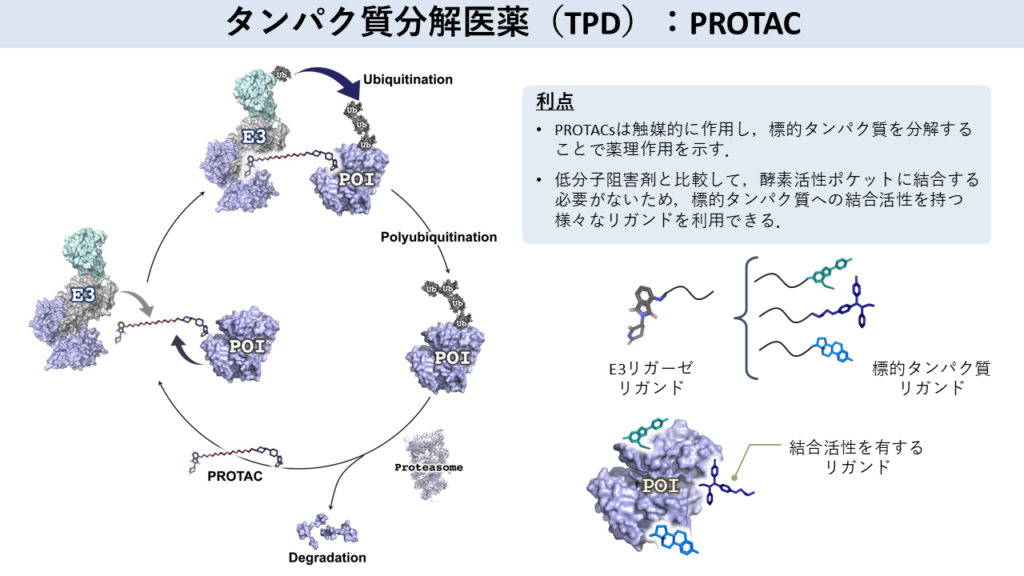
図1 PROTACの構造とユビキチン・プロテアソームシステム
PROTACは、標的タンパク質とE3リガーゼのそれぞれに結合するリガンドが主に低分子化合物で構成されているものの、これらをリンカーで連結する構造上、分子量は600〜1500程度と、従来の低分子阻害薬の2〜3倍に達することが多い。
それにもかかわらず、「PROTACは低分子阻害薬と同様に、組織移行性に優れ、経口投与も可能であるという利点を兼ね備えている」と出水氏。また、反応するのはE3リガーゼと標的タンパク質であり、PROTAC自身は触媒として機能している。そのため、「標的タンパク質の分解が終われば、PROTACは細胞内で再びUPSを誘導できる可能性がある」という。
さらに、低分子阻害薬は標的タンパク質の酵素活性ポケットに結合できる構造でなければならないが、PROTACのリガンドは標的タンパク質のどの部位に結合するものでもよい。従って、「酵素活性中心に変異が入ったタンパク質、酵素活性部位がないタンパク質なども標的とすることができる」と出水氏は利点を強調する。
一方、PROTAC開発の課題として、次の2つを挙げる。一つはE3リガーゼの多様性とその理解の不足である。ヒトのE3リガーゼは600~700種類も存在するとされているが、「どのE3がどのタンパク質を認識・分解するのか、また各組織・細胞での各種E3の発現プロファイルなど、十分には解明されていない点が多い」と出水氏は指摘する。
実際、現状ではPRPTACに利用されているE3リガーゼは、数種類で全体の90%以上を占めるという。
もう一つは、標的タンパク質を効率的に分解するPROTACの分子デザインであり、「例えば、標的タンパク質とE3リガーゼをどの程度の距離・角度で近接させればユビキチン化が効率的に起こるのかなど、構造・空間的な最適条件は未だ明確ではなく、多くの検討課題が残されている」 こうした課題に対応するため、近年ではAIや機械学習を活用した構造予測やスクリーニング手法の導入も進められつつある。
では、PROTAC開発はどこまで進んでいるのか。出水氏によると3年前の時点で、論文上で報告されたPROTACは3300種以上を超えており、その標的タンパク質はキナーゼ、核内受容体、転写関連因子、調節タンパク質など多岐にわたる。
出水氏は「特にがんの増殖に関わるキナーゼが多い」と指摘するとともに、「既存のキナーゼ阻害薬や、開発過程で有効性や選択性の問題から中止された化合物でも、PROTACとして再設計することで有用性を高める可能性があるため」と述べる。
また、PROTACは標的タンパク質そのものを分解するため、一度分解が起これば、そのタンパク質が再合成されるまで薬効が持続しやすい。さらに、PROTACは酵素的に繰り返し作用する「触媒的機構」を持つため、少量で高い活性を発揮でき、投与量の低減も可能になると説明する。
転写因子を標的にした「デコイ核酸型PROTAC」
出水氏らの研究室ではこれまで多数のPROTACを設計してきた。その代表例が造血器型プロスタグランジンD合成酵素(H-PGDS)を標的としたPROTACだ。H-PGDSはデュシェンヌ型筋ジストロフィーの病態進展に関わるタンパク質である。
出水氏らはIn silico解析を活用して、最も活性が高まるようなE3リガーゼ、H-PGDS、PROTACリンカーの三者複合体の構造を計算した。その結果、E3リガンドとH-PGDSリガンドをリンカーなしに直接結合した直結型PROTACが最も強い活性を示すことが分かった。
「直結型H-PGDS分解PROTACは、リンカーを含む従来型PROTACに比して約100倍の分解活性を示した」と紹介した上で、「さらにプロテオーム解析により、検出された約8000種以上のタンパク質の中で、H-PGDSだけが特異的に分解されており、極めて高い選択性を示すことが特徴だ」と話す。出水氏らはマウスモデルによる実験においても、心筋組織におけるH-PGDSタンパク質量減少も確認している。
もう一つの代表的研究が、転写因子を標的とした「デコイ核酸型PROTAC」の開発だ。ヒトの体内には約1600種の転写因子が存在し、約300種が発がんに関与するとされる。だが、転写因子は立体構造が複雑で結合できるリガンドが存在しないものも多く、阻害薬の開発が困難だった。
転写因子はDNAのプロモーター領域に結合し、遺伝子発現をコントロールする因子であり、必ずDNA結合領域が存在する。出水氏らはこの点に着目し、「DNA結合領域と相補的な塩基配列を人工的に合成したいわゆるデコイ核酸を作成し、これをPROTACのリガンドとして利用しよう」と考えた。
転写因子のモデルとしては、エストロゲン受容体α(ERα)を選択し、ERαに結合するデコイ核酸とE3リガーゼに対するリガンドをリンカーで結んだデコイ核酸型PROTACを設計した。さらに、リンカー長など分子デザインの最適化を行うと、最終的に高いERα分解活性を示すPROTACが完成した(図2)。
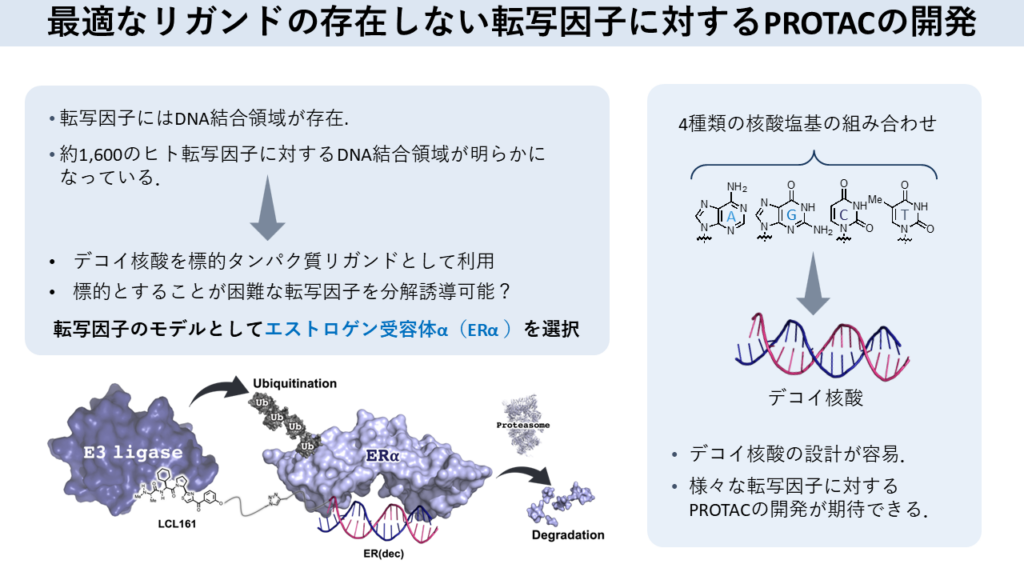
図2 転写因子エストロゲン受容体αを標的とするデコイ核酸型PROTAC
「理論的には、塩基配列さえ分かれば全ての転写因子に対してPROTACが開発できると考えられる。リガンドの片方が核酸で高分子のため、細胞内へのDDSと併用するなどの技術開発が次の課題となる」と話す出水氏は、今後のPROTAC開発に関する展望にも言及する。
一つは、ユビキチンリガーゼ研究の最新成果を応用し、副作用を最小限に抑えるPROTACの開発である。約600種類あるとされるE3リガーゼの中には、特定の疾患や組織に特異的に発現するリガーゼも報告されているため、「例えば、肝がんに特異的に発現するE3リガーゼを狙ったPROTACを投与すれば、肝がん細胞内だけでPROTACが作用してがんの進展に関与するタンパク質を分解できる。これにより、正常組織への影響を最小限に抑え、副作用の軽減が期待できる」と強調する。
さらに、「今後はアカデミアや企業の枠を超えて、PROTAC創薬のためのプラットフォームづくりを進めていきたいと思う。E3リガーゼと標的タンパク質のライブラリーなどを構築し、究極的には患者さん一人一人の疾患や病態に応じて迅速にPROTACを設計して治療する個別化医療を実現したい」と目標を語った。


