金沢大学医薬保健研究域医学系の小野賢二郎教授とエーザイの共同研究グループは7日、早期アルツハイマー病の治療薬「レカネマブ」がアルツハイマー病病態進行を抑制するメカニズムの一端を解明を解明したと発表した。
同研究は、新しく開発したレカネマブ関連アミロイドβプロトフィブリル(Lec-PF)測定系を用いて、ヒト脳脊髄液中のLec-PF濃度を測定したもの。その結果、非アルツハイマー病の対照者に比してアルツハイマー病による軽度認知障害および認知症の幅広い病期で、脳脊髄液中のLec-PF濃度が上昇し、脳脊髄液中のLec-PF濃度は神経変性を反映するバイオマーカーと有意に相関することを示された。
レカネマブは、プラークの除去作用に加えてアミロイドβプロトフィブリル(amyloid-β protofibril:PF)に選択的に結合するユニークなデュアルアクションを有する抗体で、アルツハイマー病による軽度認知障害および軽度認知症(早期AD)が対象となる治療薬である。
同研究結果より、アルツハイマー病患者の脳脊髄液中にはレカネマブが捕捉するPF(Lec-PF)が存在し、Lec-PFは神経変性に関連する高毒性の病態タンパクであることが示唆され、レカネマブがアルツハイマー病の病態進行抑制効果を示すメカニズムの一端が明らかになった。
これらの知見より、今後、脳脊髄液中のLec-PF濃度をレカネマブ治療前後で測定し、レカネマブ治療の有効性判定に将来活用できる可能性がある。
また、脳脊髄液中のLec-PF濃度は総タウ(total-tau)、ニューログラニンなどの神経変性マーカーと強く相関するため、アルツハイマー病患者の予後予測への活用にも期待できる。これらの研究結果は、6日、国際学術誌「Annals of Neurology』のオンライン版に掲載された。
アルツハイマー病(AD)の原因として、アミロイドβ(Aβ)が神経細胞外に異常凝集し、次いでタウ神経原繊維変化が生じて神経細胞の障害をきたし、疾病を発症するというアミロイドカスケード仮説が有力であると考えられている。
異常凝集したAβの中でもPFは最終段階のアミロイドフィブリルやプラークよりも神経毒性が高く、PFが神経変性を引き起こしている可能性が考えられている(Amin L and Harris DA. 2021、参考文献)。
レカネマブは、2023年より早期ADに対する治療薬として、医療現場で使用されている。だが、ヒト生体試料中のPF濃度を測定した例はこれまでになく、レカネマブの治療標的であるPFのAD病態進行における役割は、明確に解明されていない。
同研究では、プレクリニカルAD、ADによる軽度認知障害および認知症の方と、SNAP(非AD認知障害の被験者)および正常認知機能の方を対象として、新しく開発した高感度のLec-PF測定系を用いてヒト脳脊髄液中のLec-PF濃度を測定し、Aβ40、Aβ42、リン酸化タウ(p-tau)181(※9)、p-tau 217、総タウ(total-tau)、およびニューログラニン濃度との関連を解析した。
脳脊髄液中のLec-PF濃度は、正常認知機能の人(図1のYNC、AMC群)に比べてADによる軽度認知障害および認知症の人(図1のMCI+、AD+群)で有意に高値であった。
また、脳脊髄液中のLec-PF濃度と他の脳脊髄液マーカー(Aβ42、Aβ42/40比、p-tau 181、p-tau 217、total-tau、ニューログラニン)との相関解析を行った。図2はLec-PFと各種脳脊髄液マーカーのSpearmanの相関係数(95%信頼区間)を示している。被験者全体において(図2の黒線)、脳脊髄液中のLec-PF濃度は、Aβ42、Aβ42/40比、p-tau 181、p-tau 217、total-tau、ニューログラニンの全てとSpearman係数0.2以上の相関を認めました。特筆すべきことは、Aβ陽性群のみに着目した場合(図2の赤線)、 Lec-PFは AD病理であるAβカスケードの Aβの下流にあたる神経変性マーカーであるtotal-tau、およびニューログラニンとSpearman係数0.4以上の強い相関を示し、Lec-PFは神経変性に関連する高毒性の病態タンパクであることが示唆された。
今後の展開としては、脳脊髄液中のLec-PF濃度をレカネマブ治療前後で測定すれば、レカネマブ治療の有効性判定に活用できる可能性がある。また、脳脊髄液中のLec-PF濃度は神経変性マーカーと強く相関するため、AD患者の予後予測にも活用できる可能性がある。
なお、同研究は、国立研究開発法人日本医療研究開発機構(AMED)認知症研究開発事業(課題番号22dk0207053)、科学研究費助成事業学術領域変革研究(課題番号23H03850)および科学研究費助成事業基盤研究(課題番号JP19k07965、JP22k07514)の支援を受けて実施された。
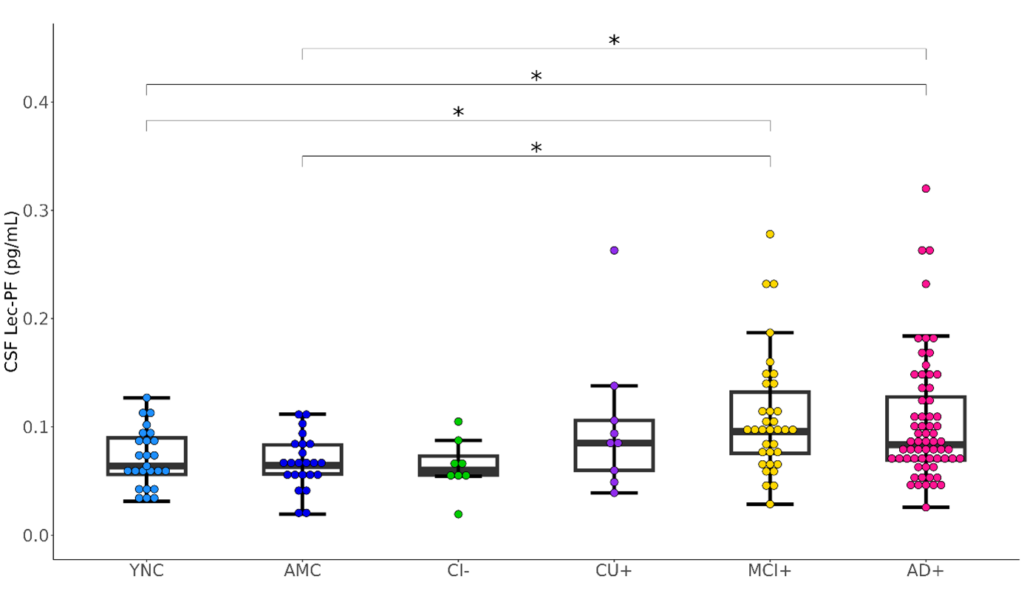
箱ひげ図のボックスは四分位範囲、水平線は中央値を示している。
各群の略語:YNC (アミロイド陰性若年正常対照群)、 AMC (アミロイド陰性同年代対照群)、CI- (アミロイド陰性認知機能低下群)、CU+ (アミロイド陽性認知機能正常群)、MCI+ (アミロイド陽性軽度認知障害群)、AD+ (アミロイド陽性アルツハイマー型認知症群)、CSF (脳脊髄液)
*p < 0.05
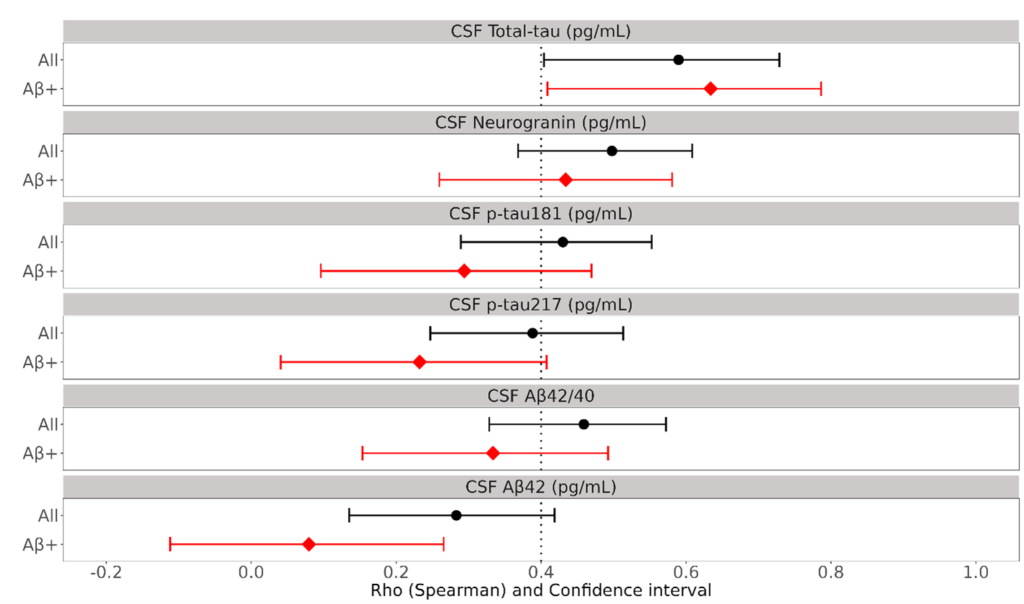
黒線は被験者全体(アミロイドβ陽性と陰性の両方を含む)、赤線はアミロイド陽性群における各脳脊髄液マーカーとCSF Lec-PFのSpearmanの相関係数の95%信頼性区間(Confidence Interval: CI)、黒点、赤点は中央値を示している。Spearmanの相関係数は、2つの変数間の順位相関の強さを示す統計学的な指標です。黒線と赤線の乖離が大きい場合は、Aβ陽性であるか陰性であるかが大きく寄与していることを示す。
今回の解析では、被験者全体(黒線)においては、CSF Lec-PFと、Aβ42、Aβ42/40比、p-tau 181、p-tau 217、total-tau、ニューログラニンの相関係数はすべて0.2以上であり、測定した全てのバイオマーカーとの有意な相関が認められました。 アミロイド陽性群(赤線)においては、神経変性のバイオマーカーであるCSF total-tauとCSFニューログラニンのSpearmanの相関係数はそれぞれ0.634(CI: 0.409-0.786)、0.434(CI: 0.260- 0.581)であり、CSF Lec-PFと2つのバイオマーカーに強い相関があることを示している。一方、Lec-PFと脳内Aβの蓄積を示すバイオマーカーであるCSF Aβ42やCSF Aβ42/40比との相関は相対的に強くない。これは、CSF中のLec-PF 量は、脳内Aβ蓄積量よりも神経変性と強い関連があることを示している。


