薬物の小胞体への取り込みを担うトランスポーター「OAT2」

体内に入った薬物は2段階の化学反応を経て代謝・排泄されるが、第II相反応で中心的な役割を果たすのが肝細胞で行われるグルクロン酸抱合反応である。
名古屋市立大学大学院薬学研究科教授の荒川大氏(医療機能薬学専攻レギュラトリーサイエンス分野)は、グルクロン酸抱合反応において、小胞体膜トランスポーターが代謝酵素や薬物の小胞体内への取り込みや排出を担い、薬物の代謝や相互作用発現に影響を与えていることを解明しつつある。
グルクロン酸抱合反応は、代謝酵素であるUGT(UDP-グルクロン酸転移酵素)を介して、薬物にUDPGA(UDP-グルクロン酸)が結合することにより、薬物が水溶性の高い代謝物に変化し、活性が低下し、尿中へ排泄しやすくする解毒機構である。だが、「ヒトの肝細胞などを使ったin vitro試験でグルクロン酸抱合反応による薬物代謝速度を予測しようとしても、非常に難しいと言われている」と荒川氏は指摘する。
予測に影響を与える要因はいくつか考えられるが、荒川氏は「UGTは細胞の小胞体中に存在しているため、UDPGAや薬物が小胞体膜を通過して小胞体中に入る過程が、グルクロン酸抱合反応全体の速度を決めるという仮説が有力」と考え、これまでヒトではほとんど解明されていなかった小胞体透過機構の研究に力を注ぐようになった。
酵母を使った研究で、SLC35ファミリーのうち3種類の小胞体膜トランスポーターがUDPGAを輸送することが分かっていた。荒川氏がUGT1A1を発現させたヒト胚性腎臓細胞HEK293細胞に、SLC35のsiRNAを23種類導入してみると、SLC35B1をノックダウンしたときにUGTの代謝活性が低下した。
次にヒト肝細胞株HepaRG細胞でSLC35ファミリー遺伝子をノックダウンしてみると、SLC35B1をノックダウンしたときだけ、UGTの代謝活性が20%程度低下した。このことから荒川氏は「ヒトでもSLC35B1トランスポーターが、小胞体へのUDPGA取り込みに関与していることが示唆された」と話す。
一方、小胞体への薬物取り込み機構については、ほとんど研究報告がなかったが、免疫細胞染色の研究によって小胞体に局在する複数のトランスポーターがあることは報告されていた。
そのトランスポーターの1つであるNPT4がグルクロン酸抱合で代謝される利尿薬ブメタニドを輸送することが分かっていたため、荒川氏はHepaRG細胞からNPT4をはじめとする複数のトランスポーター遺伝子を1つずつノックダウンしてみた。
その結果、NPT4のノックダウンでブメタニドのグルクロン酸抱合活性が低下したが、「意外にも活性がさらに大きく下がったのは、OAT2というトランスポーターをノックダウンしたときであった」という(図1)。
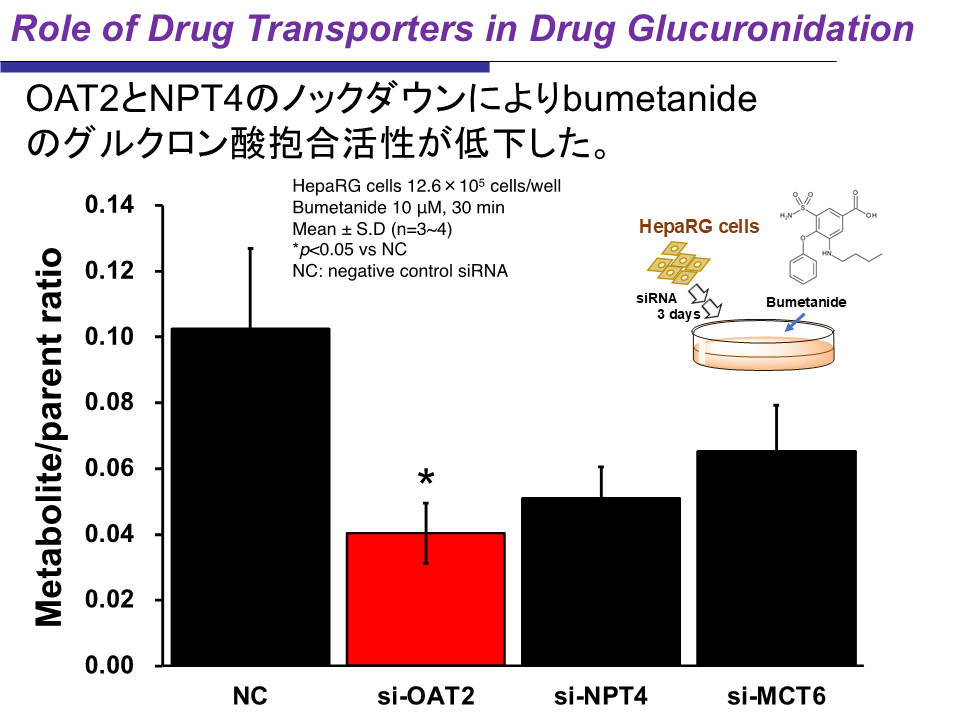
図1 小胞体トランスポーターのノックダウンによるグルクロン酸抱合活性の変化
そこで荒川氏は、OAT2にターゲットを切り替えて研究を進めることにした。OAT2はSLC22A7にコードされるトランスポーターで肝臓と腎臓で特に強く発現し、aa546タイプは細胞膜に、aa548個タイプは細胞内に分布すると報告されていたが、その機能はよく分かっていなかった。荒川氏は「OAT2のaa548は小胞体に存在する」という仮説を立て、OAT2-aa548と小胞体をそれぞれ別の色で染色してみたところ、一部の小胞体で色が重なり、小胞体にOAT2-aa548が存在することが示された。
次いでOAT2ノックアウトマウスを樹立し、免疫染色で肝細胞小胞体にOAT2が局在していることを確認した後、ブメタニドを投与してその機能を調べた。その結果、OAT2ノックアウトマウスでは、ブメタニドのグルクロン酸抱合活性が大きく低下することが示された。このとき、ブメタニドの細胞内への取り込み量に変化は見られなかった。「少なくとも、細胞内に局在しているOAT2がグルクロン酸抱合を制御していることが示された」と荒川氏は考察する。
次に着目したのは、乳がん治療薬カペシタビンの副作用である手足症候群の発症頻度は、OAT2のSNPsで変化するという臨床報告だった。カペシタビンのヒトにおける血中半減期をOAT2遺伝子野生型と変異型で比較すると、変異型の方が半減期は長かった。
続いて、カエルの卵にOAT2のmRNAを導入すると、カペシタビンやその代謝物の取り込み量は大きく増加し、OAT2がカペシタビンを輸送することが示された。
さらにヒト初代肝細胞やHepaRG細胞を用いて、OAT2とカペシタビン代謝活性の関係を調べたが、いずれもOAT2を阻害するとカペシタビンの加水分解活性が低下することが示された。カペシタビンの加水分解酵素カルボキシエステラーゼはUGTと同様に小胞体内に存在することから荒川氏は「OAT2が小胞体内に薬物を取り込んでいることが示された」としている。
OAT2は薬物相互作用の原因にもなる
荒川氏はOAT2と薬物相互作用の研究にも取り組んでいる。OAT2の基質の1つであるHIV治療薬ジドブジンの添付文書には4つの薬剤との相互作用が記載されている。
OAT2の関与を調べる前に、これらの薬剤が代謝酵素UGTを直接阻害している可能性を調べるため、ミクロソーム系を作成して実験したところ、臨床で想定される濃度では4薬剤ともUGTの阻害作用を認めなかった。
次にカエルの卵にOAT2を発現させてみると、OTA2からジドブジンとそのグルクロン酸抱合体が輸送されることが確認できた。この卵にジドブジンと4薬剤を阻害剤として添加して取り込み量を調べると、特にバルプロ酸で強い阻害作用が認められ、濃度依存的にジドブジンの取り込み量が減少した。IC50は約100μMで、阻害様式は競合阻害であった。
一方、HepaRG細胞にジドブジンと4薬剤を投与した場合は、どの薬剤も細胞内のジドブジン量には影響を与えなかったが、ジドブジンのグルクロン酸抱合体を濃度依存的に減少させていた。
「つまり、ジドブジンとこれらの薬剤を併用すると、グルクロン酸抱合反応自体に影響が及ぶことが示され、OAT2から小胞体への輸送が関与すると考えられる」と荒川氏。HepaRG細胞のOAT2をノックダウンしてみると、ジドブジンの代謝が落ちることが確認できた。
こうした実験を積み重ねた結果、「私たちの試算ではバルプロ酸とジドブジンを併用すると、ジドブジンの血中濃度が1.6倍に高まると推測できた。臨床報告では1.8倍とされているので概ね一致している。少なくとも相互作用にはOAT2が関与している」と荒川氏。
一連の研究の結論として「小胞体膜トランスポーターSLC35B1がUDPGAの、OAT2が薬物の小胞体膜透過に関わる」「OAT2が薬物相互作用の原因となる」(図2)と強調する。
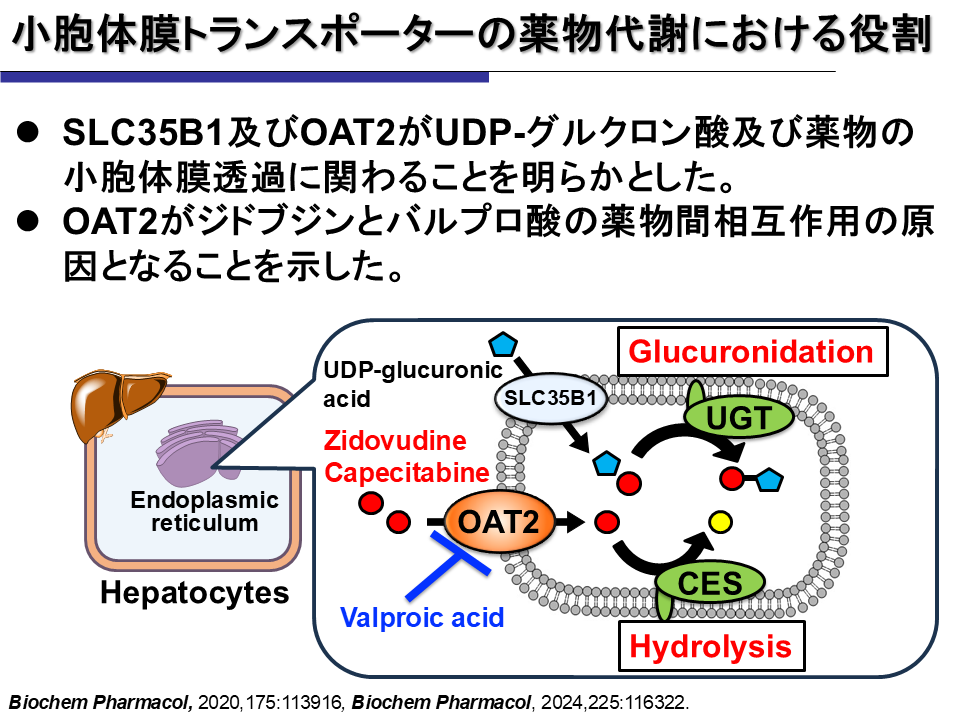
図2 小胞体膜トランスポーターの薬物代謝における役割
次に荒川氏が取り組んだのは、小胞体からのグルクロン酸抱合体の排出機構の研究である。グルクロン酸抱合体は水溶性が高く、脂質二重膜を透過しにくいため、排出時にも何らかのトランスポーターが関与していると考えられる。先に行ったジドブジンとバルプロ酸の薬物相互作用研究で、OAT2はグルクロン酸抱合体も輸送することが分かっていたため、「シンプルに考えると、小胞体で生成されたグルクロン酸抱合体もOAT2によって排出されるではないか」と考えた荒川氏は、この仮説を証明する研究を行った。
実験に適した基質として見出したのが、HIV治療薬ラルテグラビルである。まず、荒川氏はHepaRG細胞やカエルの卵を使った実験で、ラルテグラビルがOAT2の基質にはならないが、グルクロン酸抱合体の基質になる化合物であることを確認した。
その後、OAT2を発現させたカエルの卵にラルテグラビルのグルクロン酸抱合体を注入し、細胞内から細胞外への排出試験を行うと、対象群では全く排出されなかったのに対し、OAT2発現卵からは細胞外にどんどん排出され、30分後には卵内にはほとんど残存していなかった。この結果から荒川氏は「OAT2はラルテグラビル・グルクロン酸抱合体の排出を担うことが示唆された」としている。
最後に荒川氏は「引き続いてOAT2の機能解明を進める」と述べるとともに、医薬品開発への応用について言及。「2024年のICH M12ガイドラインでは薬物相互作用で注意が必要なトランスポーターとそれに対応する臨床相互作用試験の推奨基質・阻害薬が掲載されたが、近い将来、このリストにOAT2を加えることを目指したい」と目標を語った。


