「ニッチ細胞標的型抗がん剤」の創製研究加速に期待
岐阜薬科大学薬理学研究室の檜井栄一教授らの研究グループは、白血病の新しい治療標的として白血病の進展を制御する「mTORC1シグナル」を発見した。mTORC1シグナルは、細胞の成長、増殖、生存、分化など様々な機能を調節しているタンパク質複合体である。
白血病に対しては、白血病細胞(がん細胞)を標的とした治療薬が使われているが、今後、同研究成果による「がん細胞の維持や機能調節に関与する“ニッチ細胞”標的型抗がん剤」の創製研究の加速が期待される。
急性骨髄性白血病(AML)は、がん化したAML細胞が異常に増える“血液のがん”だ。AML細胞は、我々の体の中で、単独で活動しておらず、微小環境(ニッチ)という場所で、様々な細胞に囲まれて活動している。ニッチは、がん細胞などの特定の細胞を維持したり、その機能を調節する“場所”を意味する。
一方、骨芽細胞は、骨を造る細胞として良く知られているが、骨の中でニッチを構成する細胞としても働いており、AML細胞の機能を調節する働きがあることも知られている。
従って、AML細胞を支える“骨芽細胞(=ニッチ細胞)”の適切な制御が、AMLの治療成績向上に貢献することが期待される。だが、これまでに「骨芽細胞の何のシグナルをターゲットにすることで、AML細胞の機能を抑制し、AML進展を制圧できるのか?」について、詳細は明らかにされていなかった。
こうした中、檜井氏らの研究グループは、AML患者およびAMLモデル動物の骨芽細胞において、mTORC1シグナルが活性化していることを発見した。さらに、遺伝子改変動物を用いた解析やバイオインフォマティクス解析などにより、骨芽細胞のmTORC1シグナルがAML細胞の機能調節やAML進展に重要であることを明らかにした。
同研究成果は、骨芽細胞のmTORC1シグナルがAML治療における有望な創薬ターゲットとなる可能性を明らかにしたもので、AMLだけでなく、様々な難治性がんの治療成績向上を指向する「ニッチ標的型抗がん剤の創製」に繋がることが期待される。これらの研究成果は、2025年12月24日に米国学術雑誌『iScience』に掲載された。
AMLは、進行の早い難治性の“血液のがん”であり、小児から高齢者まで幅広い世代に発症する。小児白血病の1/4がAMLとされている。また、加齢とともに発症頻度は上昇し、高齢者ほど治療成績が悪く、70歳以上では5年全生存率は10%を下回るといわれている。
強力な化学療法や造血幹細胞移植などによりAMLの治療成績は良くなっているものの、治療薬の強い副作用や耐性獲得、寛解後の再発、加齢による治療選択肢の制限などの問題もあり、新たな治療法の開発が希求されているのが現状だ。
AML細胞は、様々な細胞に囲まれた“微小環境=ニッチ”に存在しており、その複雑な環境が治療を難しくしている。さらに、骨形成を担う骨芽細胞がニッチ細胞として、AML細胞の機能調節に重要な役割を担っていることが明らかにされてきた。
従って、AML細胞自身を制圧するだけでなく、骨芽細胞(=ニッチ細胞)を介してAML細胞を制圧することができれば、AMLの治療成績のさらなる向上が期待できる(図1)。
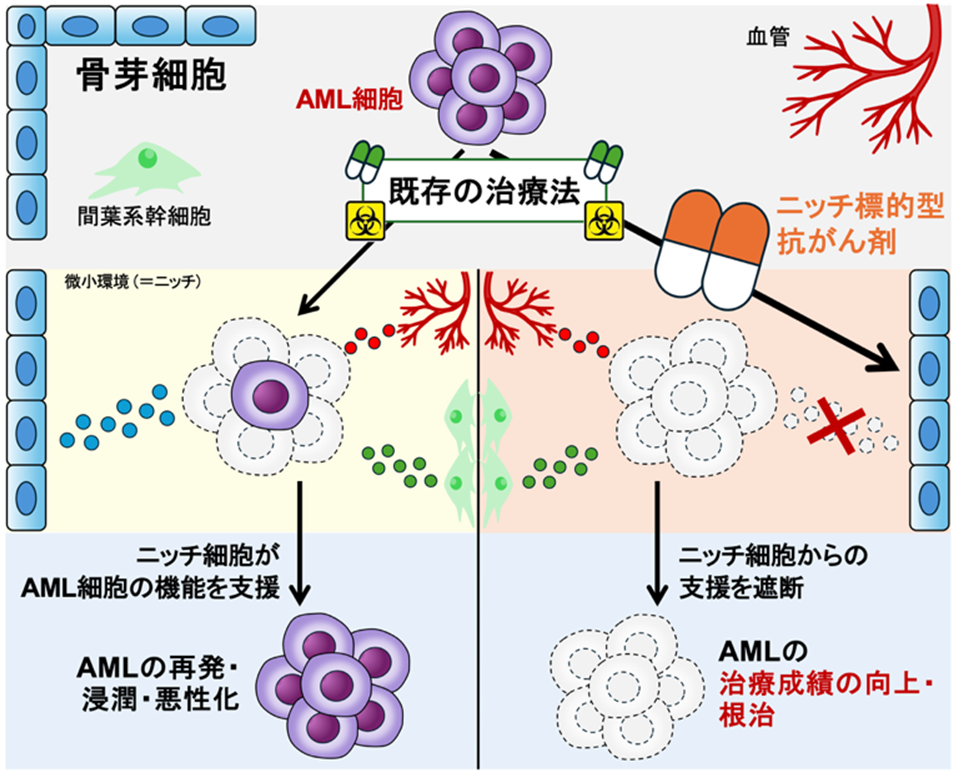
図1:ニッチ細胞の制御はAMLの治療成績の向上や根治に重要である。
だが、これまでに骨芽細胞がどのようなシグナルを介して、AML細胞の機能調節に関わっているのかについて、全貌は明らかになっていなかった。そこで、研究グループはまず、バイオインフォマティクス解析手法を用いて、 AMLモデル動物の骨組織の解析を行った。
その結果 、AMLモデル動物の骨芽細胞では、mTORC1シグナルが活性化していることが分かった(図2A)。さらに、病理検体を用いた解析により、AML 患者の骨芽細胞においても同様に、mTORC1シグナルが活性化していることが明らかになった (図2B)。
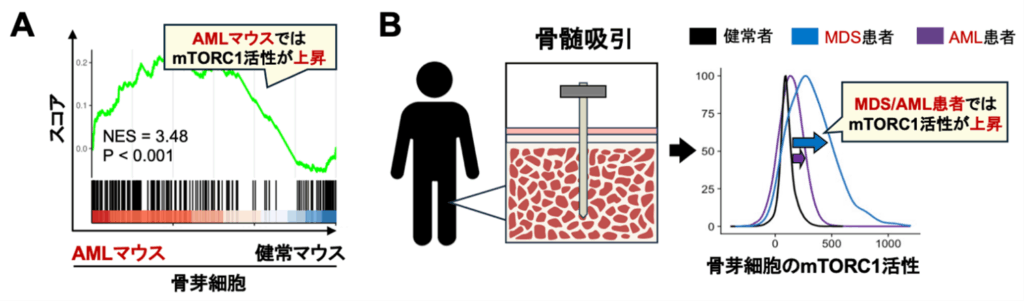
図2:AMLモデルマウスおよびMDS/AML患者の骨芽細胞ではmTORC1シグナルが活性化している。
次に、骨芽細胞のmTORC1 シグナルを活性化することによって(=骨芽細胞特異的なmTORC1活性化マウスの作製)、AMLにおける骨芽細胞のmTORC1シグナルの役割を明らかにすることを試みた。
その結果、骨芽細胞特異的なmTORC1活性化マウスでは、骨髄中や血中のAML 細胞が著明に増加しており、さらに、AMLの著明な進展が観察された(図3A, B)。逆に、骨芽細胞のmTORC1 シグナルを不活性化すると(=骨芽細胞特異的なmTORC1不活性化マウスの作製)、AMLが著明に抑制された(図3C)。これらの結果から、骨芽細胞のmTORC1シグナルは、AML細胞の機能とAMLの進展にとても重要であることが明らかになった。
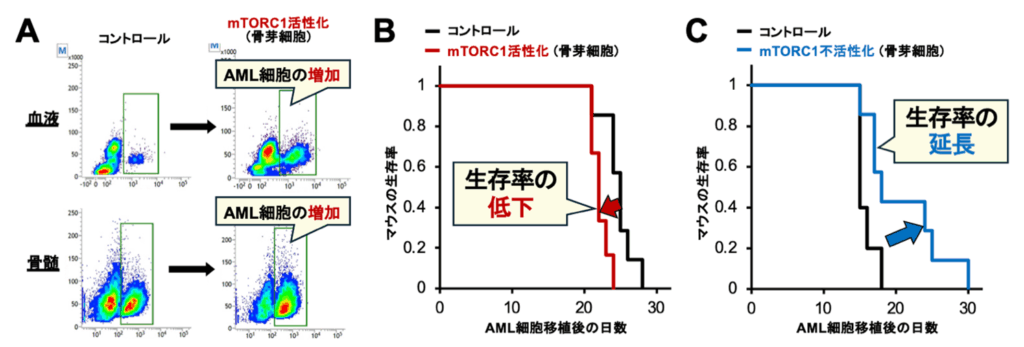
図3:骨芽細胞のmTORC1シグナルを活性化させるとAMLは進展し、逆に不活性化させるとAMLは抑制される。
次に、「どうして骨芽細胞のmTORC1シグナルを調節することで、AML細胞の機能やAMLの進展が変わるのか?」という疑問の解決に着手した。バイオインフォマティクス解析やAMLモデル動物を用いて、詳細な解析を行ったところ、骨芽細胞のmTORC1シグナルが活性化すると、IL6というサイトカインが増加し、AML細胞の機能を調節していることが分かった(図4A, B)。

図4:mTORC1シグナルが活性化した骨芽細胞は、サイトカイン・IL6を介してAML細胞の機能を調節する。
以上の結果により、骨芽細胞のmTORC1-IL6シグナル調節が、AML細胞の機能やAMLの発症に重要な役割を果たしていることが明らかになり、骨芽細胞(=ニッチ細胞)のmTORC1-IL6シグナルが、AMLの治療における有望な創薬ターゲットとなる可能性を見出した(図5)。
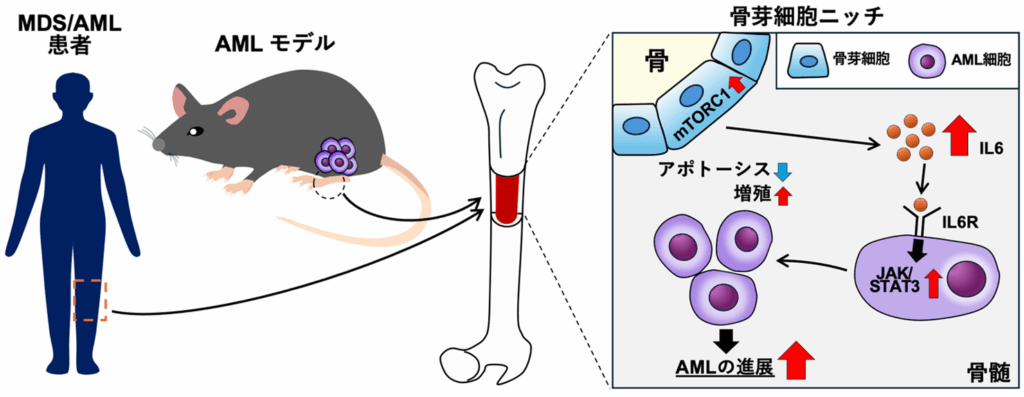
図5:骨芽細胞 (=ニッチ細胞) のmTORC1-IL6シグナルは、AMLに対する新規創薬標的候補となる。
同研究では最初に、病理検体の解析およびバイオインフォマティクス解析により、AML患者およびAMLモデル動物の骨芽細胞において、mTORC1シグナルの活性化を見出した。さらに、細胞特異的遺伝子改変マウスを用いた遺伝学的実験などにより、骨芽細胞のmTORC1-IL6シグナルがAML細胞の機能調節やAML進展に重要な役割を果たしていると判明した。これらの結果から、骨芽細胞(=ニッチ細胞)のmTORC1-IL6シグナルは、AMLに対する新規創薬標的候補となることが明らかになった。
同研究成果は、「がん細胞の特性や機能を制御する微小環境=ニッチ」について、新しい知見を提供するとともに、「ニッチ細胞の機能調節が、がんの制御に重要」という概念に新たなエビデンスを付与する。白血病に対しては、白血病細胞(がん細胞)を標的とした治療薬が使われているが、AMLの治療成績向上のため、今後、同研究成果に基づき、「ニッチ標的型抗がん剤」の創製研究を加速していく。
また同研究成果は、AMLに限らず、“微小環境=ニッチ”が悪性化に寄与する様々な難治性がんに対する革新的治療法を提供し、アンメット・メディカル・ニーズの解消にも貢献するものと期待される。


