東京大学アイソトープ総合センターの野村幸世特任教授(星薬科大学教授)とJCRファーマの今川究ユニット長らの研究グループは17日、胃がん腹膜播種に対して幹細胞とα線を組み合わせた新たな治療法を開発したと発表した。
新治療法は、歯から得られる「歯髄由来幹細胞」に放射性同位元素アスタチン-211 を取り込ませ、がん細胞を選択的に攻撃するもの。同研究成果は、困難な胃がん腹膜播種治療の新たな選択肢となる可能性を示している。なお、同研究グループには、東北大学金属材料研究所の吉野将生特任准教授、理化学研究所仁科加速器科学研究センターの羽場宏光室長らが参加している。
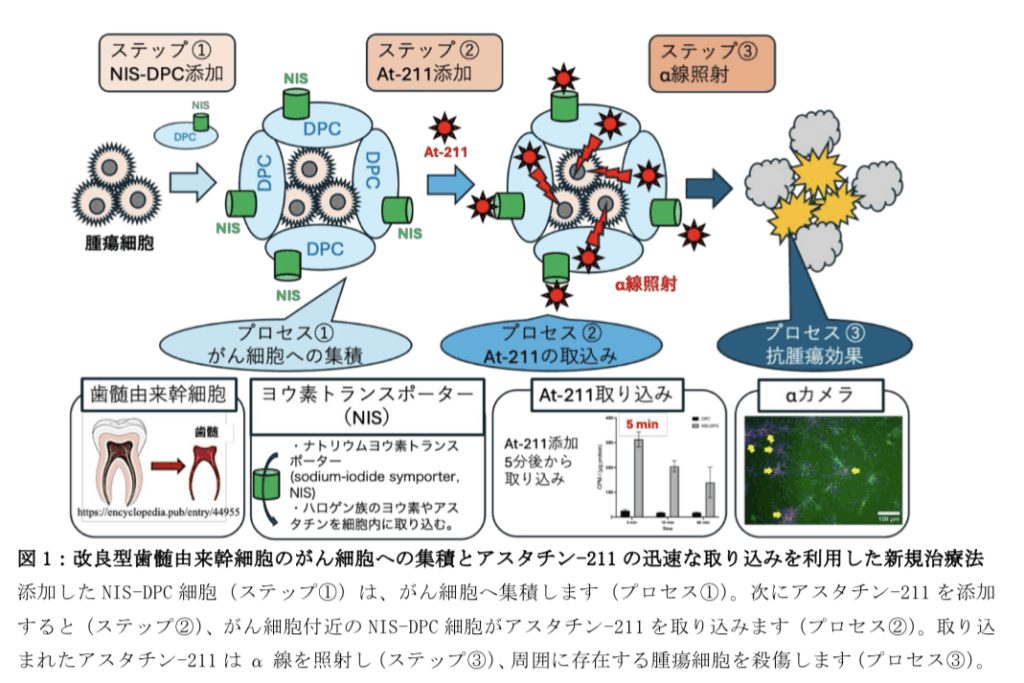
今回の研究では、胃がん腹膜播種部位に集まりやすい歯髄由来幹細胞に、アスタチンと同じハロゲン族元素を効率的に取り込む特殊な遺伝子(ヨウ素トランスポーター)を組み込んだ。
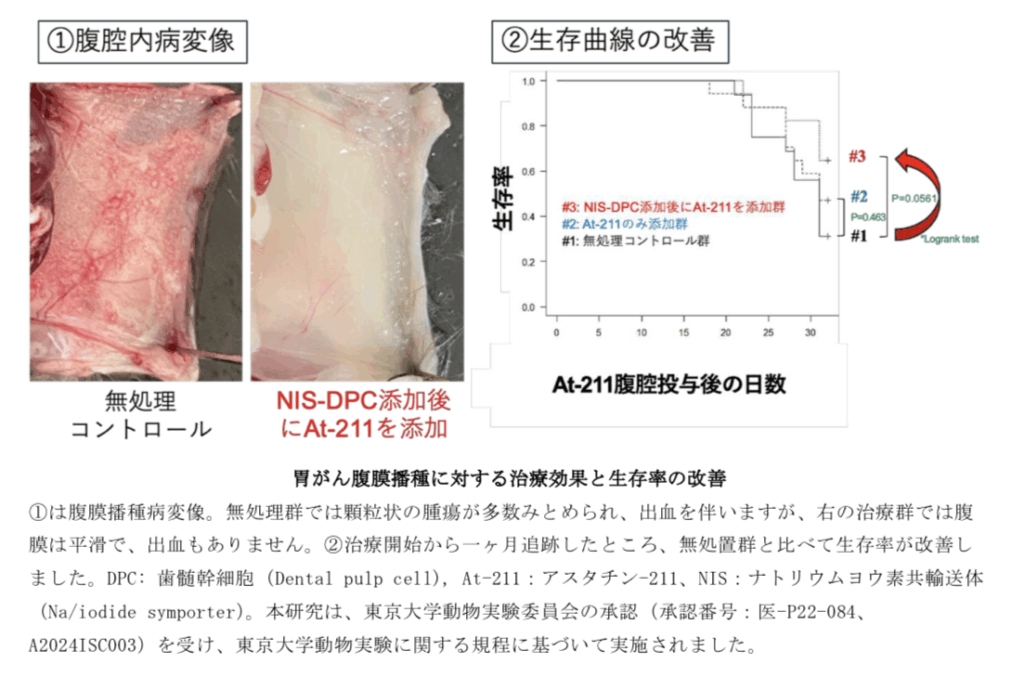
この改良型幹細胞をあらかじめ動物モデルの腹腔内に投与し、その後アスタチン-211を投与したところ、わずか5分後には幹細胞がアスタチン-211を取り込み、その後α線を放出して近くのがん細胞を選択的に破壊することが確認された。その結果、がんの進行が抑制され、生存率の改善が確認された。
胃がんが進行すると、がん細胞が腹膜に広がって転移を起こす「腹膜播種」が発生する。腹膜播種は外科手術や化学療法の効果が限られており、治療が極めて難しいため、長年にわたり新たな治療法の開発が求められてきた。
2016年に、がん細胞に対して強い殺傷力をもつα(アルファ)線の効果が明らかになり、近年では日本国内でも、理化学研究所などで半減期が7.2時間と非常に短い放射性元素であるアスタチン-211の製造・供給体制が整った。これにより、α線を利用した核医学治療の研究開発が急速に進んでいる。
DPCとアスタチン-211の特性を組み合わせた新たな腹腔内播種戦略開発
腹腔内播種は切除できないために、胃がん、膵臓がん、卵巣がん、大腸がんなど様々ながんにおいて治療が難しく、化学療法の効果も不十分である。野村氏らは、マウスモデルにおいて、歯髄細胞(dental pulp cell, DPC)とアスタチン-211を用いた胃癌腹膜播種治療の新戦略を開発した。半減期が7.2時間の短寿命α線放出核種であるアスタチン-211は、理化学研究所RIビームファクトリーのAVFサイクロトロンを用いて大量に合成され、高純度に化学精製された。
腹膜播種マウスモデルは、免疫能を有する C57BL/6マウスに移植可能なマウス胃癌細胞株YTN16を用いて確立された。ドナー由来ヒトDPCを培養増殖させ、レンチウイルスによりナトリウムヨウ素共輸送体(Na/iodide symporter, NIS)を導入して、NISを発現するDPC細胞(NIS-DPC細胞)を製造した。
腹腔播種発生後1週間経過した時点で、0.5×10^6 個のNIS-DPCを隔日で3回に分け腹腔内移植した。その後、0.6MBqのアスタチン-211を腹腔内投与、長期評価のため、マウスを1ヶ月間観察した。
NIS-DPC-At-211投与群では、非投与群、遊離アスタチン-211投与群、と比較して、犠牲マウスの腹腔内播種が良好に抑制された。カプラン・マイヤー生存曲線解析によって、これらの治療群では生存期間が他群と比較して有意に延長していることが確認された。
in vitro の観察において、アスタチン-211はNIS-DPC細胞に添加後5分で蓄積しており、がん細胞に対するアスタチン-211標識抗体による集積にくらべて迅速であることが判った。また、α線をリアルタイムで可視化するαカメラで観察したところ、NIS-DPC 細胞からα線が放出されていることが直接認められた。
α線は、従来治療に用いられているβ線や、γ線に比べて、高いエネルギーを伝達できるため、がんを効率的に除去できる。また、作用範囲は約100μmで数細胞程度と短く、漿膜側から腸管粘膜を損傷しない。DPCは抜歯した歯からの採取が可能で、他人の細胞でも移植可能という特性を持ち、癌細胞周辺へ移動・蓄積が可能である。
一方、NISはアスタチン-211を迅速に取り込む特性をもつ。こうして、NIS-DPC内のアスタチン-211から放出されるα線は、周辺のがん細胞を殺傷することができる。このように、DPCとアスタチン-211の特性を組み合わせた新たな腹腔内播種戦略が開発された。
将来的には、この方法を臨床に応用することで、胃がん腹膜播種に対する新しい治療の選択肢が生まれるものと期待される。また、今後、α線放出核種の取り扱いに関する法規制が見直され、外来での点滴治療が可能になれば、患者の就労と治療の両立が実現する可能性もある。
同研究は、標的α線治療と再生医療の融合による革新的なアプローチであり、治療が難しい腹膜播種に対して光明をもたらす成果だ。今後は、臨床応用に向けた安全性や有効性の検証を行い、臨床応用を目指した研究開発が行われる予定である。


