細菌感染を制圧する新たな医療基盤の創出に期待
岐阜大学大学院医学系研究科の横山達彦助教、京都大学医生物学研究所の秋山芳展教授らの研究グループは、細菌が環境の鉄イオンを感知する分子メカニズムを解明した。
分子モーターが生み出した機械的な力が内膜に存在する膜タンパク質FecRにも伝達されることにより、鉄の取り込みだけでなく、外界に鉄が存在するという情報の伝達にも、細菌が環境中の鉄の存在を「知る」仕組みが利用されていることを明らかにした。
細菌感染による病態の悪化には、鉄の効率的な取り込みを介した細菌の増殖が深く関与しており、今回明らかにされた細菌の鉄感知機構は、細菌が感染を成立させるメカニズムの解明とともに、細菌感染を制圧する新たな医療基盤の創出への応用が期待される。
これらの研究成果は、4月17日にProceedings of the National Academy of Sciences of the United States of America (PNAS)誌のオンライン版で発表された。
生命は、生存に不可欠な元素である鉄を取り込むために、巧妙なシステムを進化させてきた。効率的に鉄を取り込むために、細菌は外界の鉄を感知することができるが、その分子メカニズムの全容はこれまで不明であった。
細菌は鉄を取り込む際に、分子モーターが生み出す機械的な力を利用することが知られている。横山氏らは、この力が、情報伝達を担う膜タンパク質「FecR」にも伝わり、FecRの連続的な切断を引き起こすことを突き止めた。さらに、こうして生じたFecR断片が、鉄の取り込みに必要な遺伝子群の発現を誘導することを明らかにした。同研究成果は、タンパク質切断を介した情報伝達の新たなメカニズムを提示し、生体機能制御の基盤となる仕組みの一端を明らかにしたものだ。
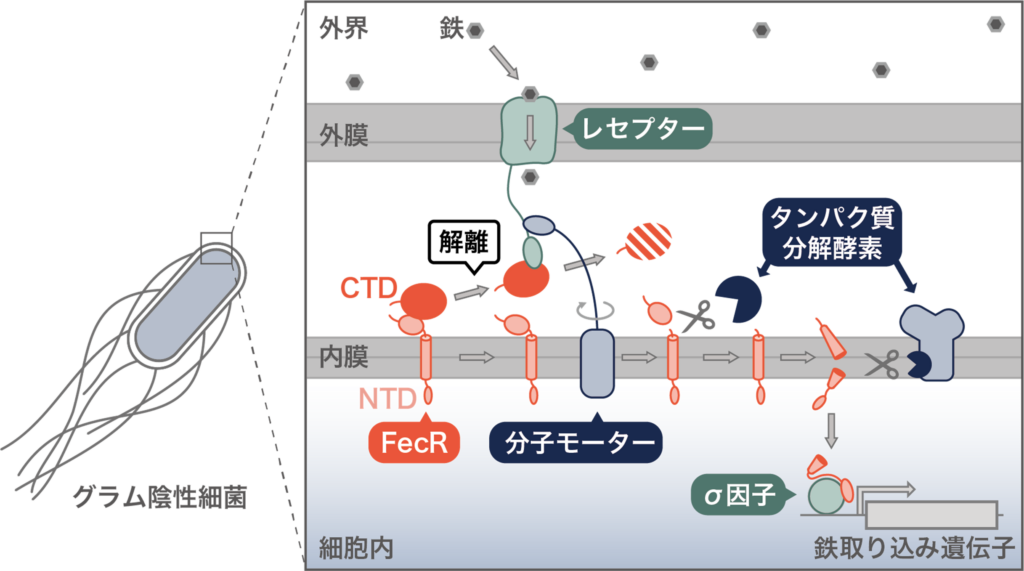
グラム陰性細菌は外膜と内膜と呼ばれる2枚の膜で外界と隔てられている。細菌の内膜には分子モーターが存在しており、プロトン駆動力を利用することで、機械的な力を生み出す。細菌はこの機械的な力を用いることにより、外膜に存在するレセプタータンパク質が捕まえた外界の鉄を、細胞内へと引き込むことが知られている。このように鉄を細胞内に取り込む機構については研究が進んでいる一方で、外界に存在する鉄をどのように感知してその情報を細胞内に伝え、鉄取り込みに必要な遺伝子の発現を誘導するのかという仕組みについては分かっていなかった。
同研究では、分子モーターが生み出した機械的な力が内膜に存在する膜タンパク質FecRにも伝達されることを突き止めた。それにより、鉄の取り込みだけでなく、外界に鉄が存在するという情報の伝達にも、この力が利用されていることを明らかにした。
さらに、FecRは、NTD領域とCTD領域の2つの領域に分離された状態で内膜に挿入されることを発見した。分子モーターによる機械的な力は、レセプタータンパク質を介して、FecRのCTD領域に伝達され、これによりCTD領域がNTD領域から解離することを見出した。
CTD領域が解離すると、NTD領域はタンパク質分解酵素によって連続した2度の切断を受けることも解明。さらに、最終的にNTDから生じる小さな断片が膜から細胞内へと移行し、σ因子を活性化することで、鉄を取り込むシステムを構成する遺伝子の発現が誘導され、細菌はより効率的に外界の鉄を取り込めるようになることが判った。
同研究では、膜タンパク質が厳密に制御されながら連続的に切断されることで、細胞外の情報が細胞内へと伝達される分子機構を明らかにした。こうしたタンパク質の切断を介した情報伝達は、細菌に限らず、ヒトを含む多くの生物種にも見られ、細胞死、コレステロールの合成、神経変性疾患の発症など、生命にとって重要な現象に関与している。
同研究は、タンパク質切断を伴う新たな情報伝達のメカニズムを解明し、生体機能制御の根幹を成す仕組みの一端を明らかにしたものだ。
また、細菌感染による病態の悪化には、鉄の効率的な取り込みを介した細菌の増殖が深く関与している。同研究で明らかにした細菌の鉄感知機構は、細菌が感染を成立させるメカニズムの理解を深めるとともに、細菌感染を制圧するための新たな医療基盤の創出にもつながるものと期待される。
◆横山達彦氏のコメント
本研究で対象とした情報伝達システムの存在自体は、半世紀近く前から知られていた。だが、このシステムのコアである、FecRが情報を伝達する分子メカニズムは謎に包まれてきた。
本研究では、FecRが細胞内で合成され、膜へと挿入され、最終的に分解されていく過程、いわばFecRタンパク質の「一生」を精緻な生化学的解析により紐解くことで、情報伝達メカニズムの全容を明らかにした。
今後、類似したタイプの情報伝達機構の研究を進める上で、本研究が必要不可欠な礎になると信じている。最後に、本研究の基盤となった数多くの研究を推進し、本研究領域の発展に多大な貢献をされてきた、マックスプランク生物学研究所(ドイツ)のVolkmar Braun博士に心から敬意を表したい。


