信州大学先鋭領域融合研究群バイオメディカル研究所平塚佐千枝教授と、岐阜大学応用生物科学部上野義仁教授らの研究グループは、短鎖合成RNAが新しいタイプのがん転移抑制剤となりうる可能性を見出した。
研究グループは、これまで細胞外に存在するmRNAのうち、特別な配列をもつものは、免疫細胞の表面の受容体に結合することにより、そのがん転移抑制能を向上させることを同定してい。だが、天然のmRNAは体内ではすぐに分解されてしまう欠点があった。
そこで、活性化に必要な短い配列を同定するとともに、安定化修飾を施したmRNAを新たに合成し、マウス個体に投与したところ、がん細胞の肺転移を抑制することができた。
この実験では合成mRNAを複数回投与してもサイトカインストームなどの副作用や免疫細胞の疲弊が見られないという利点があることが判った。さらに、がん患者からナチュラルキラー(NK)細胞や細胞傷害性T細胞(CTL)を単離し、合成修飾mRNAを用いて活性化すると、これらの細胞は活性化前よりもより多くのヒトのがん細胞を殺傷することが確認できた。
これらの研究成果は、2025年2月25日19:00(日本時間)にシュプリンガー・ネイチャー社の学術誌Nature Communications にオンライン掲載された。
がん細胞は、ほぼすべての人に発生することはよく知られている。がんが一定の大きさになると遠隔の臓器に転移が起こり、がんの死因の90%以上は転移によるものだ。
これまでの多くの研究から、がん細胞そのものと転移する臓器の環境の両方の因子によってがん転移が成り立つことが判ってきた。転移する臓器には、少数ながらがん転移の抑制する役割を果たす抗転移免疫細胞が存在する。この細胞表面には、mRNAに対する受容体タンパク質が発現しており、小胞に包まれていない細胞外mRNA(Nex-mRNA)の特殊配列が結合することにより細胞が活性化する。
mRNAは、細胞の遺伝情報をもとにタンパク質を合成するための鋳型となることが本来の生理機能である。だが、この場合は細胞間の情報伝達物質として働いているという全く別の生理機能を発揮している。
天然のmRNAは血液中ではすぐに分解されてしまうので、そのままでは薬剤として使用することはできない。そこで平塚氏らは、生体内で容易に分解されず、かつ免疫細胞を活性化するという合成修飾mRNAを作製した。
塩基数が50-60個程度の化学修飾RNAを安定的に合成することが技術的に可能なので、同研究では特殊な配列と化学修飾をもつ50塩基のRNA(s-mRNA)を合成した。RNA(s-mRNA)は天然のmRNAと同等の、免疫細胞(NK細胞・細胞傷害性T細胞)活性化能を持ちながら、血液中のRNA分解酵素で分解されないという性質を兼ね備えたものだ(図1)。
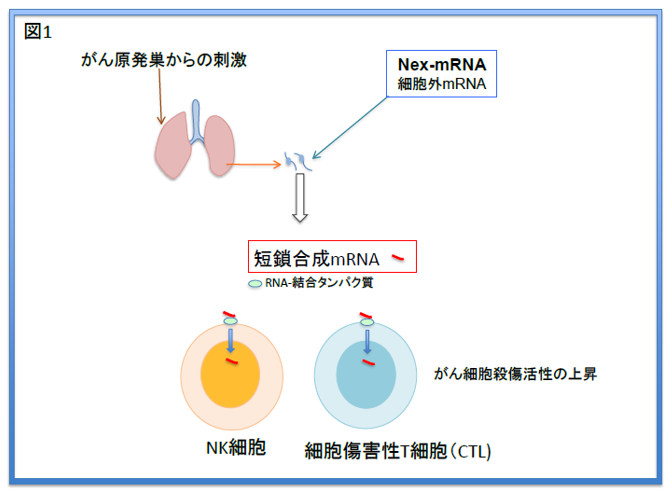
mRNA配列は担癌マウス(皮下などに原発がんを移植したマウス)の肺組織に存在する細胞外mRNAに基づいて設計された。NK細胞・細胞傷害性T細胞にはmRNAの受容体が発現している。
この受容体は合成s-mRNAを取り込むことも可能であり、その結果、これらの細胞ではがん細胞を殺傷する能力が強化される。
同研究により平塚氏らが見出した合成s-mRNAによる免疫細胞活性化には2つの利点があることが判った。1つは顕著な副作用が見られなかった点である。免疫細胞が活性化することにより炎症性サイトカインが産生されるなどの応答反応が引き起こされ、これらの応答反応が過剰になるとさまざまな悪影響がもたらされる。マウスを用いた実験では、合成s-mRNA投与による明らかな生体組織への影響は見られなかった。
もう一つの利点は、複数回の投与でも効果が持続することだ。免疫細胞を活性化するための薬剤を投与した場合、投与回数を重ねるとその効果が出にくくなるのはよくある事例であるが、合成s-mRNA投与実験ではそのような効果の減少はみられなかった。
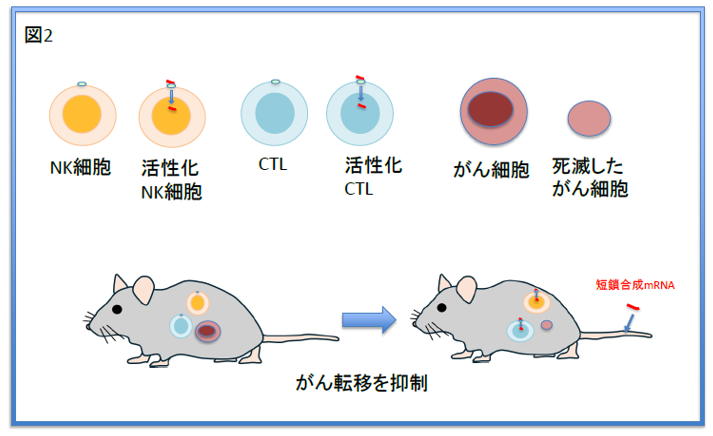
大腸がん患者さんから単離したNK細胞やCTL細胞と、ヒト大腸がんの細胞株を免疫不全マウスに移植する実験を行い、s-mRNA投与により肺転移を抑制できることを示した(図2)。
これらの結果から、合成s-mRNAが、新しいタイプのがん転移抑制剤であることが結論づけられた。
現在の医療では、転移を抑えることが、がんの治療に必須なことは分かっていますが、効果的な抗転移薬として確立したものはない。今回の結果より、短い合成修飾mRNAで、がんの転移の予防や、初期の治療薬として、簡便に安全に使用できる可能性があり、開発を加速していく。


