全身投与を介した様々な疾患治療への応用に期待
東京工業大学物質理工学院材料系の安楽泰孝准教授(ナノ医療イノベーションセンター[iCONM]副主幹研究員)らの研究グループは、mRNAの効率的な生体内送達に向けて、TPP(トリフェニルホスホニウ)をベースとした新規カチオン性材料を用いたmRNA内包高分子ミセルを創製に成功した。
今回構築したTPPベースの高分子ミセル表面に適切なリガンドを修飾し、対象疾患に合わせた治療用タンパク質をコードするmRNA を搭載することで、全身投与を介した様々な疾患治療に応用できると期待される。
これまでの研究で、mRNA を効率的に送達する多様な脂質キャリアや高分子キャリアが開発されているが、いずれのキャリアもmRNAと静電相互作用を介して複合体形成するため、アミンをベースとした材料が汎用されてきた。同研究では、従来の設計で見落とされてきたアミン以外のカチオン性官能基によるmRNA複合体安定化に着目。本研究で用いたTPPベースの新規カチオン性材料は、アミンをベースとする従来のカチオン性材料と比較して、生体内における mRNAの安定性を大幅に向上させ、全身投与を介した mRNAの効率的な生体内送達を実現した。
同研究ではさらに、この mRNA 安定化のメカニズムを物理化学、生物学、計算科学など多面的な解析から解明し、mRNA 送達キャリア設計におけるアミンからTPPへの変換の妥当性と有用性を実証した。
アミンから TPP への変換というこの戦略は、現在 mRNA 送達に使用されている様々なカチオン性材料に適用可能と考えられ、今後、mRNA 送達キャリアの多様化・高機能化に寄与することが期待される。同研究成果は、7月10日付の英国王立化学会が発行する科学誌「Materials Horizons」に掲載された。
タンパク質の設計図であるmRNAは、様々な疾患へ適用可能な新規治療薬として近年注目を集めている。だが、mRNA には生体内不安定性や細胞膜非透過性などの問題があるため、mRNA創薬においては、mRNAを標的部位へ効率的に送達可能なキャリア設計が極めて重要となる。
これまでに、脂質や高分子から構成される多様なキャリア設計が報告され、mRNAの安定化や生体内送達が試行されてきた。だが、従来のほとんどの設計が、mRNAとの複合体形成をアミンとの静電相互作用に依存しており、アミン以外のカチオン性官能基による mRNA 複合体化は未開拓であった。
同研究では、アミンの代替としてTPPに着目し、その有用性を検証した。TPP は 3 つのフェニル基を持ち、従来のアミンとは異なり、中心のカチオン原子が窒素原子ではなくリン原子であることから、従来のアミンとは mRNA との相互作用が異なると予想される。
同研究では、従来核酸の送達に用いられる高分子ミセルをモデルキャリアとして使用することで、TPPを用いたmRNAとの複合体形成のメカニズムと、その生体内送達の効果を検証した(図 1)。
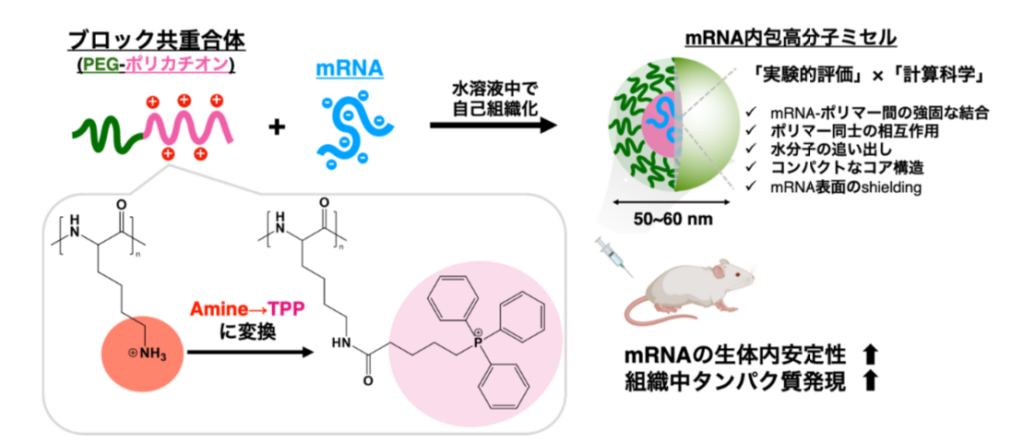
まず、高分子ミセルを構成するカチオン性材料としてブロック共重合体PEG-poly(L-lysine)(PEG-PLys)を使用し、側鎖のアミノ基にアミド結合を介してTPPを導入した。PEG-PLys 側鎖への TPP 導入率は精密に制御可能であり、導入率の異なる5種類のブロック共重合体(ポリマー)を合成した。いずれのポリマーも側鎖の正電荷に起因して水溶液中で優れた溶解性と分散性を示す一方で、TPP を導入したポリマー(PEG-PLys(TPP))は、溶液中のNaCl濃度に応答して自己集合挙動を示した。
この挙動は、塩化物イオンがポリマー間の静電反発を遮蔽することで、TPP の疎水性に起因するポリマー間の疎水性相互作用が促進されたことを意味しており、TPP の併せ持つカチオン性と疎水性が、アニオンに応答したポリマーの自己集合能を誘導することが示されたことになる。この性質は、PEG-PLys(TPP)がアニオン性分子を効率的に内包できる可能性を示唆している。
次に、mRNAとPEG-PLys(TPP)ポリマーを水溶液中で混和して、mRNAとの複合体を形成させることで、mRNAを内包した高分子ミセルを調製した。粒子径が100 nm以下の高分子ミセルに、さまざまな長さのmRNAを効率的かつコンパクトに封入可能であることを確認した。
この複合体形成時に生じるポリマーとmRNA間の相互作用を熱力学的観点で解析したところ、PEG-PLys ポリマーはエンタルピー駆動型の発熱反応を示すのに対し、PEG-PLys(TPP)ポリマーはエントロピー駆動型の吸熱反応を示した。
この結果は、TPP導入に伴い、mRNAとの相互作用が静電相互作用支配的な結合から水分子の排除を伴う疎水性相互作用支配的な結合に変化することを示唆している。
さらに、分子動力学シミュレーションを用いて、ポリマーとmRNA間の相互作用を原子レベルで解析した。アミンとTPPの構造上の違い、すなわち「側鎖長」「フェニル基の有無」「中心原子の違い(N 原子 vs P 原子)」が、それぞれ「mRNA 分子に対する親和性向上」「mRNA周辺からの水分子の排除および mRNA 表面の被覆」「ポリマー同士の親和性向上」に寄与することが示唆され、アミンからTPPへ構造を変換する戦略の妥当性を支持する知見を得た。
従来の高分子を用いたmRNAの生体内送達では、生体内のアニオン性高分子によるキャリア構造の崩壊やRNA分解酵素によるmRNA分解が大きな障壁となる。
今回の研究では、こうした生体内成分に対するmRNA安定性を、TPPの導入によって顕著に向上させられることを確認した。TPPを導入した高分子ミセルによる細胞内への mRNA 送達能を、培養細胞を用いて評価したところ様々な細胞種においてTPP導入率が高いほど細胞内へのmRNA 送達とタンパク質発現が促進されることが分かった。
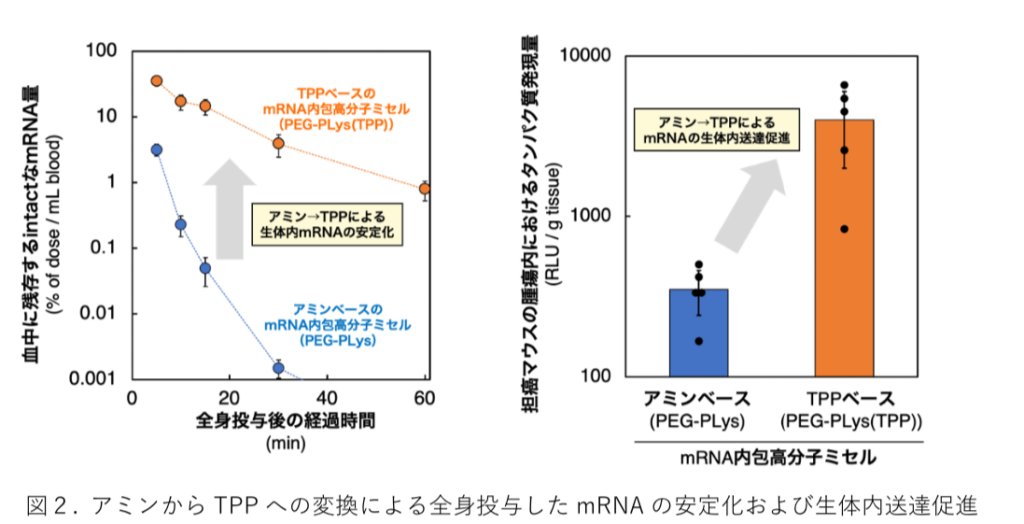
最後にマウス体内での mRNA安定性および送達能を評価した(図2)。アミンまたはTPPをベースとした高分子ミセルをマウス静脈内にそれぞれ投与し、血中に残存するmRNAを定量RT-PCRで評価した。
アミンベースの高分子ミセルの場合、投与後速やかに血中から mRNAが消失したのに対し、TPPベースの高分子ミセルでは血中を循環するmRNA量が大幅に増加した(図2 左)。
さらに、TPPベースの高分子ミセルでは、全身投与後に生体内の各組織へのmRNAの送達も促進され、担癌マウスの腫瘍組織におけるタンパク質発現量がアミンベースの高分子ミセルの約10倍に達した(図 2 右)。
これらの結果から、mRNA送達キャリアにおけるカチオン性材料をアミンからTPPへ変換することで、全身投与したmRNA のバイオアベイラビリティを向上させ、生体内組織でのタンパク質発現を促進することが示された。
今回の研究では、mRNA 送達キャリアにアミンの代わりにTPPを導入することで、生体内でのmRNA安定性を向上させ、生体内組織への効率的な送達を実現するというアプローチを採用した。この新たな送達戦略は、高分子ミセルだけでなく、脂質や他の高分子ベースなどさまざまな種類のmRNA 送達キャリアにも適用可能であり、今後のmRNA送達キャリアの多様化と高機能化に貢献すると期待される。
こうしたmRNA送達戦略の発展は、mRNA 創薬の前進にもつながると期待される。様々な薬物送達に使用される高分子ミセルは、組織浸透性や免疫回避能などの特徴に加え、表面にリガンドを修飾することで標的細胞への特異性を付与できるという利点がある。
今回構築したTPPベースの高分子ミセル表面に適切なリガンドを修飾し、対象疾患に合わせた治療用タンパク質をコードする mRNA を搭載することで、全身投与を介したさまざまな疾患治療に応用できると期待される。
また、同研究で実施した実験的評価と計算科学を組み合わせた複合的アプローチは、今後さらなる高分子材料設計に有用と考えられる。


