シェディングは細胞間コミュニケーションを調節する

タンパク質には修飾を受けることで生体内での機能が変わる性質がある。「シェディング」は細胞膜に埋め込まれた膜タンパク質をプロテアーゼと呼ばれるタンパク質を切るハサミが切断し、細胞外領域を可溶化するタンパク質修飾機構である(図1)。
立命館大学生命科学部教授の白壁恭子氏(生命医科学科タンパク質修飾生物学研究室)は、「細胞は種々のシグナル分子や受容体を介してお互いにコミュニケーションしているが、受容体の多くは膜タンパク質であり、シグナル分子にも膜タンパク質がシェディングされることで放出されるものが多い。例えば、炎症性サイトカインのTNFα、上皮細胞成長因子EGFファミリーなどは、もともと膜に発現していたタンパク質が切断され、遊離した分子だ」と説明する。
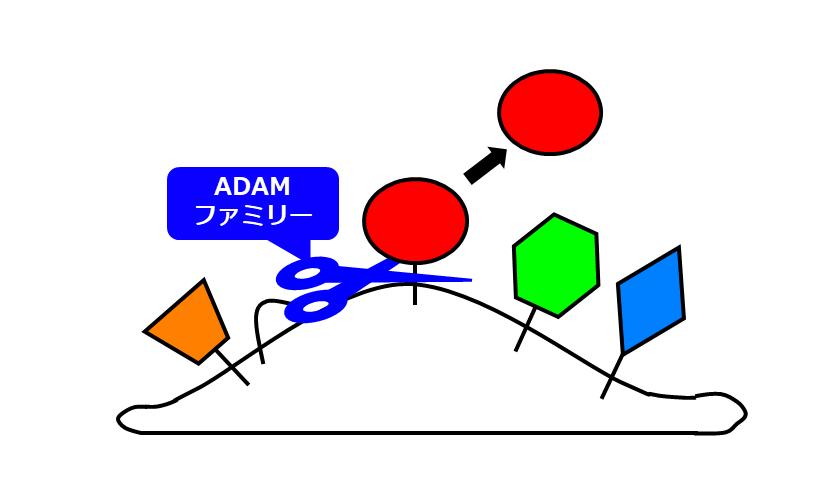
膜タンパク質の細胞外の領域がADAMファミリーにより切断されて放出される
白壁氏によると、膜タンパク質のシェディングによって、①切断された細胞外領域がシグナル分子として放出される、②受容体が切断され、細胞内へのシグナルが遮断される、③接着分子が切断され、細胞間の接着が弱くなる、④別のプロテアーゼによるさらなる分解により細胞内領域が可溶化して核に移行し、遺伝子発現を調節する――など、細胞間コミュニケーションを調節する現象が起きるという。
「シェディングによって、膜に囚われていたタンパク質が自由になり、変身して新しい機能を獲得するようなイメージに魅力を感じ、ずっと研究を続けている」と白壁氏。
また、膜タンパク質の分解機構は他にもあるが、「シェディングはハサミが膜タンパク質に直接作用するので、比較的短い時間で膜タンパク質の機能を制御できるという特徴がある」と指摘する。シェディングの異常によって引き起こされる病気も存在し、2011年にはNew England Journalに炎症性皮膚・腸疾患(Inflammatory Skin and Bowel Disease)の原因遺伝子としてシェディングを担うプロテアーゼの一つであるADAM17の欠損が報告されているが、「この病気では、シグナル分子のシェディングが起こらないことで皮膚のバリア機能が低下し炎症反応が過剰になるなど、様々な症状が現れる」と白壁氏は指摘する。
シェディングでは主にADAMファミリーという一群のプロテアーゼがハサミの役割を担う。すべての膜タンパク質が一律にシェディングされることはなく、状況に応じて特定の膜タンパク質だけが選択的にシェディングされるのだが、そのメカニズムは不明な点が多い。白壁氏はこのシェディングの特異性を生み出す仕組みの解明をめざした。
炎症反応時のマクロファージではシェディングが活性化してTNFαが盛んに放出されるが、TNFα以外にもシェディングされる膜タンパク質はあるのか、それらの膜タンパク質はどのようにして選ばれるのか。白壁氏はまず、プロテオーム解析の技術を用いて、炎症反応時のマクロファージからシェディングによって放出されるタンパク質を網羅的に調べるシェディングスクリーニングの実験を行った。
マクロファージに炎症反応を引き起こすLPSだけを添加した群(シェディングあり群)と、マクロファージにLPSとADAMファミリー阻害剤を添加した群(シェディングなし群)を比較してみると、18種類のタンパク質がシェディングのターゲットとして同定できた。白壁氏はそれらのタンパク質が選択的にシェディングされる分子機構について解析を進めた。
ハサミに不利な要素がシェディング感受性を決定する
接着分子CADM1は白壁氏がシェディングターゲットとして同定した膜タンパク質の一つである。CADM1には膜貫通領域の直前、まさにシェディングで切断される部分をコードする選択的エキソンであるエキソン9があり、選択されるとシェディングが起き、選択されないとシェディングが起きないことがわかった(図2、左)。さらに研究を進めると、CADM1の膜貫通領域直前は糖鎖で覆われており(図2、左、波線)、エキソン9がコードする「糖鎖で覆われていない5つのアミノ酸」があることでADAMプロテアーゼによる切断が可能になることがわかった。白壁氏は糖鎖が結合するたった2つのアミノ酸を、糖鎖が結合しないアミノ酸に置換することで、シェディングされなかったCADM1がシェディングされるようになることも確かめている。
また、別の接着分子ALCAMでも、膜貫通領域の直前に選択的エキソンであるエキソン13があり、選択されるとシェディングが起きず、選択されないとシェディングが起きるこ
とがわかった(図2、右)。ALCAMのエキソン13には糖鎖が結合するアミノ酸配列は存在しなかったが、負電荷を持つアミノ酸が多数存在し、シェディングを阻害していることが明らかになった。
これらの研究成果から、白壁氏は「これまでは、シェディングされる膜タンパク質にはハサミが切断しやすい要素があるに違いないという視点から考えられていたが、私は逆にハサミにとって不利な要素、切断を阻害する要素があるかないかで、シェディングされるかどうかが決定されると考えている(図2)」と結論付ける。

さらにALCAMのエキソン13をノックアウトしたマクロファージ細胞を作成して対象群と比較すると、エキソン13ノックアウト細胞ではシェディングが亢進し、細胞の動きが活発化することがわかった。
「ALCAMは細胞内領域を介してアクチン骨格と繋がっているので、シェディングされることで細胞外と細胞骨格との連携が乱され、細胞の運動が亢進したのではないかと考えている。シェディングによりマクロファージの運動が活性化することが、効果的な炎症反応に重要なのではないか。シェディングの特異性を決める分子機構についてはある程度理解が進んだので、今後はシェディングが持つ生物学的な意味を明らかにしていきたい」と白壁氏。現在は炎症、免疫、がんに関連する細胞などでシェディングの生物学的意味を解明する研究を続けている。
「疾患の治療法開発への応用はまだ先の話になるが、例えばシェディングによって細胞外に放出されるタンパク質をバイオマーカーとして利用する方法や、シェディングによって機能変化するタンパク質をターゲットにした免疫療法などが考えられるのではないか」と白壁氏は話している。


