
レオロジー(流動学)は物体の粘性や弾性を研究する学問である。固体(弾性体)に外力を加えると変形するが、内部から反発力(応力)が生じて、外力を除くと元の形状に戻ろうとする。液体(粘性体)では応力が生じず、外力を除いても元の形状には戻らない。医薬品や化粧品では、固形剤、液剤のほかに、その中間に位置する粘弾性体の製剤も多用されている。
静岡県立大学薬学部の近藤啓氏はこのレオロジーに興味を持ち、「基礎研究と医薬品としての実用化の間を埋める仕事がしたい」と大手製薬企業の製剤部門からアカデミアに転じた研究者である。
近藤氏は「実は医薬品の製剤研究の現場では、製剤の特性を示す科学的、客観的な指標が存在していないものも幾つかあった」と指摘する。例えば、貼り心地の良い貼付剤、液だれしないスプレー剤、速く崩壊して嚥下しやすい経口剤などを開発する際は、薬物と何種類もの基剤や添加剤の配合割合を変えて多数の試作品を作製し、最も適した製剤を探るといった方法が一般的であった。
「製剤の特性を示すような科学的かつ定量的な指標ができれば、効率的に製剤設計が行えるようになる」と考えた近藤氏は、レオロジーの観点から医薬品の製剤設計に適応できる指標を確立するための研究を重ねてきた。
近藤氏によると、これまでにも物体をかき混ぜるなどせん断応力を加えると粘度が下がり、応力を取り除くと徐々に粘度が回復するチキソトロピーという現象を表す指標はあったが、どのくらいの時間で元に戻るかといった、時間軸を加えた指標はなかったという。
例えば、点鼻スプレー剤の場合、噴霧時は粘度が低くなった方がスプレーしやすいが、噴霧された投与部位ではできるだけ速やかに適切な粘弾性を有するゲルを形成して滞留することが望ましいため、時間軸での評価が欠かせない。
近藤氏は、さまざまな組成の製剤を作製し、外力を加えて構造をいったん破壊し、外力を取り除いてからそれらが1秒間に何%構造を回復するかを計測する実験を重ねた。この「1秒間に何%構造回復するか」を表す指標が、近藤氏が考案し、提唱している「ゲル初期構造回復速度」である。
例えば、ゲル初期構造回復速度の違う製剤を点鼻スプレー容器で4センチ離れた板に噴霧する実験を行うと、一般的な市販製剤は25秒で全て液だれしてしまうが、ゲル初期構造回復速度が最も高い数値を示した製剤を噴霧すると、90秒後にも0.1センチしか液だれせず、ほとんどが噴霧された箇所に留まっていた。
だが、初期回復速度が最も高い製剤は粘度が高すぎて噴霧しにくいという欠点もあり、「市販製剤との中間の数値を示す製剤が点鼻スプレー剤としては適しているといえる」と近藤氏は結論付ける。
同様に近藤氏は、経口固形剤についても実験を重ねた。経口固形剤では服用後の崩壊を促進するために崩壊剤が添加されるが、崩壊剤には主に水を吸収することで崩壊させる導水型と、水を含むことで膨らんで崩壊させる膨潤型がある。
それぞれ吸水量や吸収速度、膨潤量や膨潤速度といったデータは出ているが、崩壊挙動において粘弾特性の観点からは研究されてこなかった。近藤氏は膨潤型のクロスカルメロースナトリウム(CCS)、導水型のコーンスターチ(CS)、両方の性質を持つとされるクロスポピドン(CPV)を用いて、粘弾性からの崩壊特性を定量的に評価する方法を研究した。
各種崩壊剤に水を加え、含水率と湿性粉体の応力、含水率と湿性粉体の粘性の寄与度の計測を試みた。一般に粉体に液体を添加していくと、パサパサ領域からネバネバ領域に移行する可塑限界を経て、ネバネバ領域からドロドロ領域に移行する液化限界に達する。
膨潤型のCCSでは水を添加し始めると膨潤が始まるため、応力が速やかに低下するが、可塑限界を境に応力は横ばいになった。
一方、導水型のCSでは水を添加し始めると粉体が水を引き込み、可塑限界までは応力の変化は見られない。だが、可塑限界を超えると湿性粉体が粘性体としての性質を強めるため、一気に応力は低下する。また、CSは可塑限界と液化限界が近いため、可塑限界以上の水を引き込むことで崩壊するという特徴が示された。
近藤氏は、これらの崩壊特性を「膨潤崩壊指数」、「導水崩壊指数」という2種の指数で表すことに成功し(図1)、「膨潤型は可塑限界前に力を発揮し、導水型は可塑限界以降に力を発揮することが数字で示された。製剤の目的によって、これらを使い分けるなど製剤の評価や設計を効果的に進めることができると考えている」と説明している。
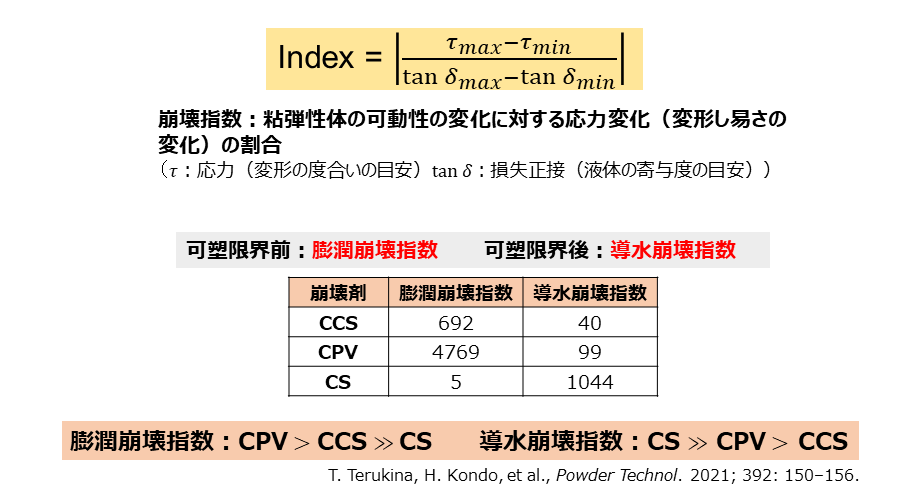
(CCS=クロスカルメロースナトリウム、CPV=クロスポピドン、CS=コーンスターチ)
ナノファイバーで消化管粘膜付着性のDDS製剤を開発中
近藤氏のもう一つの研究テーマが、ナノファイバーシートによる新しいDDSの開発だ。同製剤は直径1~1,000 nmの繊維状物質をシート状に加工したもので、表面積が極めて大きいため吸収性や接着性が非常に優れるという特徴を有する。
創傷治療剤など、さまざまな医療分野で開発が進められているが、近藤氏が研究しているのは吸収されにくい薬のDDSとしての利用である。
「吸収の最も基本的なメカニズムは濃度勾配だ。吸収されにくい薬物でも、濃度の高い状態で長時間、消化管に滞留させることができれば吸収させることができる。極めて表面積の大きなナノファイバーシートは組織への吸着性、接着性が高いため、消化管の表面に長時間付着させることができるのではないか」
こう考えた近藤氏は、消化管粘膜付着性放出制御製剤の開発をめざして、いくつかの基剤をさまざまな径のナノファイバー、およびそれを用いたシートに加工し、付着性と薬物溶出性の実験を繰り返した。ラットにアシクロビル(ACV、吸収されにくい薬物)を投与した実験では、液剤を経口投与した群では1.3時間後に薬物は血中濃度のピークを迎えて8時間後には消失したが、ナノファイバーシート(NFS)をカプセルに入れて経口投与した群は24時間後にも一定の血中濃度が維持されていた(図2)。投与8時間後のラットの胃には、ナノファイバーシートの残滓を確認した。
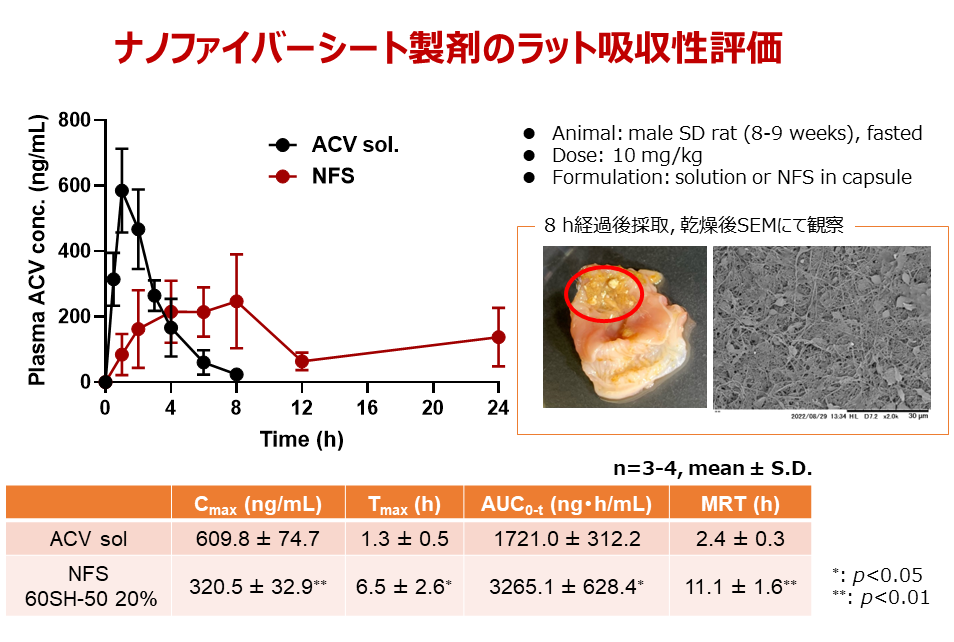
「ナノファイバーシートによる消化管粘膜付着性放出制御製剤は吸収促進剤を添加しなくても、吸収性の低い薬物を吸収させることができる。ナノファイバーは安全性の高い基剤で構成されており、消化管の粘膜上皮細胞のターンオーバーにより、自然に排出されると考えている」と述べるとともに、「現在は粘弾性の観点から粘膜付着性が高いナノファイバー基剤の検証を行っている」とレオロジー研究との関連を示す。
最後に近藤氏は「レオロジーとナノファイバーシートの研究の最終目標は、生分解性の細胞シートなどを用いた再生医療への応用だ。構造体で幹細胞を培養して臓器や組織に留置する場面を考えると、目標の臓器や組織に適応した粘弾特性と付着性を持った構造体を設計する必要がある。さらに研究を加速させたい」と展望を語った。


