がん治療やNMR解析などの細胞応用に利用

早稲田大学大学院情報生産システム研究科の三宅丈雄教授、理化学研究所生命機能科学研究センターの美川務専任研究員らの研究グループは、1000万個の細胞に複数タンパク質を「高効率」「高生存率」導入できるナノ注射器を開発した。
再生医療分野で取り扱うために必要な細胞数である1000万個以上の細胞に対して、導入効率89.9%、細胞生存率97.1%でタンパク質導入に成功したもの。同技術をがん治療やNMR解析などの細胞応用に利用できることを実証している。
2021年に報告した導電性高分子で被覆された金属製ナノチューブシートをこれまで細胞内に届けることが困難であったタンパク質向けに改良し、タンパク質の細胞内への輸送速度や細胞内での機能維持の向上を実現した。
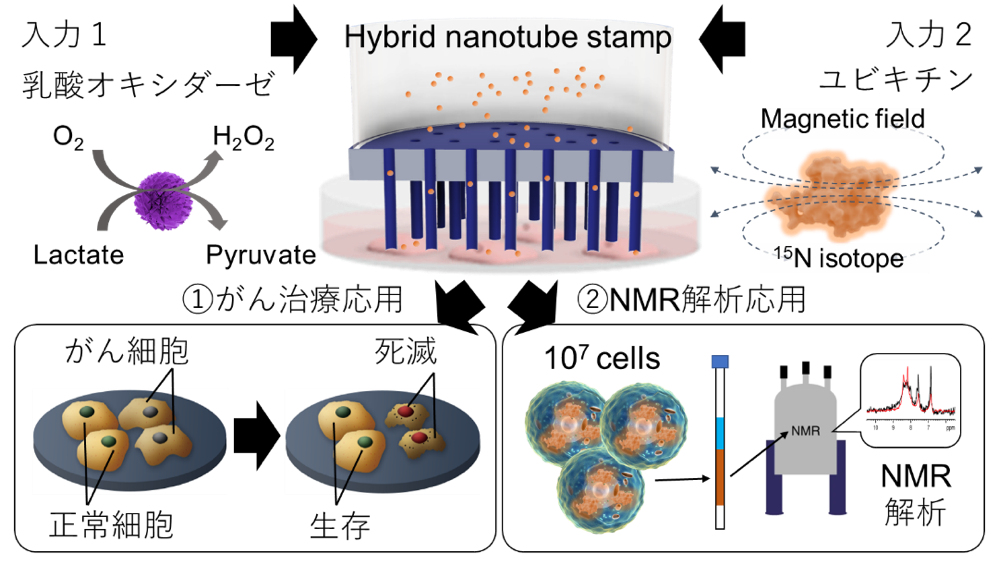
同研究では、この技術を用いて、乳酸オキシダーゼ酵素(LOx)を正常細胞とがん細胞に導入し、がん細胞のみが死滅することを確認した(図1)。実験では、酵素が細胞内まで届けられた場合は24時間後にがん細胞が3%まで死滅するのに対し、酵素を細胞内に届けない条件では33%残ることが確認された。
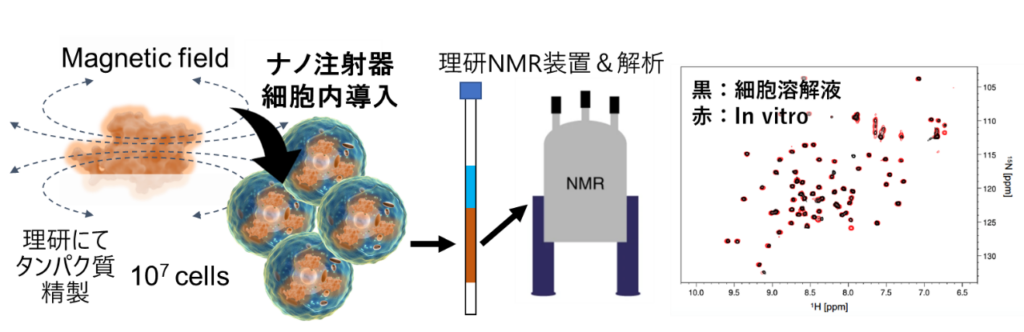
一方、安定同位体標識タンパク質(ユビキチン)を細胞内機能解析手法であるin-cell NMR解析に必要な1000万個(107個)以上の細胞に対して、高効率および高生存率で導入することに成功した。
これらの研究成果は、科学研究費補助金、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ「電子・イオン制御型バイオイオントロニクス」(JPMJPR20B8)、旭硝子財団の助成によるもので、本年5月14日に科学誌『Analytical Chemistry』にオンライン版で公開された。
体外で細胞に物質を導入し、細胞を加工する技術開発は、再生医療および細胞治療におけるコア技術で、これまでは化学/生物的手法(ウィルスベクター)と物理的手法(エレクトロポレーション)が利用されていた。
だが、これら手法は、細胞が外界から物質を取り込む作用であるエンドサイトーシスにより細胞内への取り込みを行うため、時間がかかり、効率が悪く、導入する過程で細胞が死んでしまうなどの課題を有していた。
こうした課題を解決するため、中空管のマイクロ/ナノニードルを細胞に挿入することで、目的の物質を細胞内に導入するナノ注射器に関する取り組みが盛んに推進された。
とはいえ、開発が進むナノ注射器は単針であり、かつ、マイクロサイズの細胞に単針を挿入するマニュピレータが必要であるため、主に1細胞ごとに導入する必要があった。
そこで、同研究グループは、ナノチューブを配列した2次元薄膜(シート)を開発し、本ナノチューブを細胞に刺入することで短時間、かつ、高効率に物質を細胞に届けるナノ注射器の開発に成功した。
さらに、同研究では、このナノ注射器を用いることで、これまで物質導入が困難であった機能性タンパク質を再生医療分野で取り扱うために必要な細胞数(107個以上)に高効率および高生存率で導入できることを確認。同技術をがん治療やNMR解析などの細胞応用に利用できることを実証している。
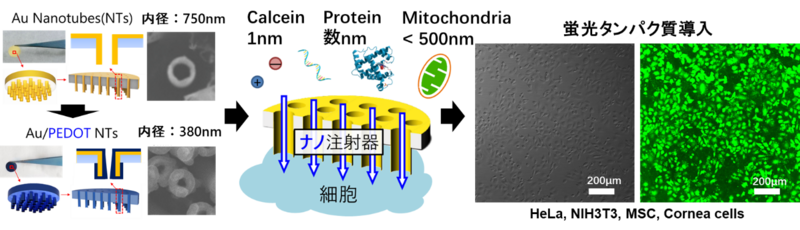
同研究グループでは、これまで金属製のナノチューブを開発し、そこへ導電性高分子を被覆することでナノスケールの構造体(ナノ構造体)および物質輸送を制御できるナノ加工技術(新しいナノ材料)の開発に取り組んできた。
加えて、新規ナノ構造体を基盤とするナノ注射器を開発し、細胞内に低分子(蛍光物質:約1nmサイズ)・中分子(タンパク質:約数nm)・高分子(細胞小器官:500nm以上)を導入する取り組みを実施してきた。
今回、複数のタンパク質を細胞内に高効率・高生存率で導入するためのナノ構造体を開発し、様々な細胞(がん細胞(HeLa))、マウス由来上皮細胞(NIH3T3)、ヒト由来繊維芽細胞(HPS)、脂肪由来幹細胞(MSC)、角膜上皮細胞(HCE-T)など)で実現できることを確かめた(図2)。
同技術を用いた事例には、①乳酸オキシダーゼ酵素(LOx)導入によるがん細胞の死滅、②安定同位体標識タンパク質導入によるNMR解析ーがある。まず、①LOx導入によるがん細胞の死滅に関しては、原理はとてもシンプルで、細胞内でLOxが乳酸濃度に応じて過酸化水素(H2O2、強力な酸化剤)を生成し、その結果として細胞をアポトーシス(細胞の自然死)に導く。
図3に示したようにがん細胞(HeLa)と正常細胞(MSC)内の乳酸濃度は10倍程度異なるため、がん細胞の中では酵素反応によって過酸化水素がより多く生成されることになる。同実験では、HeLaとMSCへのLOxの導入効率は共に95%以上を示した。
LOxを導入したMSCと何も処理しなかったMSCを比較すると、ほぼ同じ生存率(100%以上)を示すのに対し、がん細胞ではLOx導入後、生存率が時間と共に下がることを確認している。
さらに、LOxの導入量に応じて、生存率が変化することを確かめており、このことは酵素反応の結果としてがん細胞が死滅したものと考えられる。
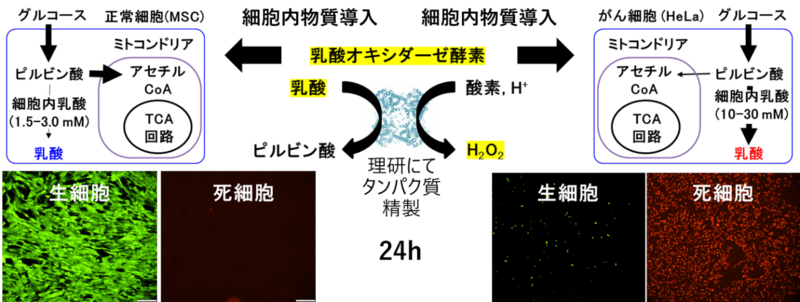
(生細胞はカルセインAMで蛍光染色を行い、死細胞はPIにて蛍光染色を行った。)
また、②安定同位体標識タンパク質導入によるNMR解析においては、①同様の手法でユビキチンタンパク質をHeLa細胞に導入しNMR解析を行いました(図4)。NMR解析には、高濃度のタンパク質が導入された細胞が107個程度必要となるため、ナノ注射器システムでも十分な数の細胞を用意し、さらには、十分な量のタンパク質が細胞内に導入されたかどうかを確かめました。結果として、1.8×107個の細胞に5-10Mの安定同位体標識ユビキチンが入ったことをNMR解析から明らかにしました。
今後は、任意のタンパク質や低分子を同時に細胞内に導入することで、細胞機能改変(ダイレクトリプログラミング)あるいは細胞内機能解析(In-cell NMR)などの開発にも取り組んでいく。
また、動物性細胞以外の細胞(植物、酵母、乳酸菌など)への展開も見込んでいる。なお、これらを1研究室で実現することは困難なため、同研究グループでは、このプロジェクトに興味のある企業や研究機関からの問い合わせを待っている。同研究に関するお問い合わせ先は、早稲田大学大学院情報生産システム研究科三宅丈雄教授まで。
電話:093-692-5158 E-mail:miyake@waseda.jp


