肝臓や炎症組織に効率的に薬物や治療細胞を届ける

京都大学大学院薬学研究科の山下富義教授(薬品動態制御学分野)らの研究グループは、低分子化合物からペプチド・タンパク質、核酸、細胞などへと進化する薬物のモダリティに対応したドラッグデリバリーシステム(DDS)の研究開発を続けてきた。
山下教授は、「DDSの開発研究では、薬物自身はもちろん、それを標的組織に運ぶキャリアについて、生体内でのADME(吸収、分布、代謝、排泄)、物質としての性質(生体適合性、薬物放出性、標的結合力)、サイズや形状、安定性、さらには細胞内での動態などについて研究することが重要である」と指摘し、薬物の投与設計、製剤設計、さらに毒性や副作用も含めた評価系についての研究を進めている。
例えば、代表的なDDS製剤として薬物を脂質二重層の小胞内に含有させたリポソーム製剤が知られている。リポソームの表面を糖鎖で修飾すると肝臓に効率よく取り込まれるようになるが、山下教授らは糖の種類により肝臓内での分布を制御できることを証明した。肝臓構成細胞表面には異なるレクチン様受容体が発現し、それぞれ違う糖鎖を認識するからである。また、マンノースで修飾したリポソームは、抗原提示細胞へのデリバリーにも応用でき、がん抗原をコードしたプラスミドDNAでがん免疫を誘導できると言う。
これを発展させたのが、帝京大学の丸山一雄教授(当時)と共同で行った超音波応答性バブルリポソームの応用研究だ。超音波造影ガスに超音波を当てると膨張が起こり、これを内包するリポソームがバブルのように破裂する。その勢いにより、プラスミドDNAなど大きな高分子を標的細胞内に導入することができる。バブルリポソームをマンノース修飾すればDNAを抗原提示細胞に導けるので、到着した時点で超音波を照射することで、効率よく標的細胞内にDNAを導入できる。
また、糖修飾リポソームは炎症部位へのDDSとしても期待される。炎症を起こした血管内皮細胞にはセレクチンタンパク質が発現し、これらが糖鎖と結合することで、白血球が血管内皮を通過して組織に浸潤するのを助けるメカニズムがある。山下教授らは、岐阜大学・安藤弘宗教授らと共同で、シアリルルイスXというE-セレクチンが認識する最小単位の構造をさらに単純化し、その人工糖鎖で修飾したリポソームを創製した。この構造単純化シアリルルイスXで修飾したリポソームは、PEG修飾リポソームや元のネイティブなシアリルルイスXで修飾したリポソームよりも効率的に炎症血管内皮細胞内に取り込まれ、血管新生を阻害するエベロリムスの送達効率を増強できることを明らかにしている。
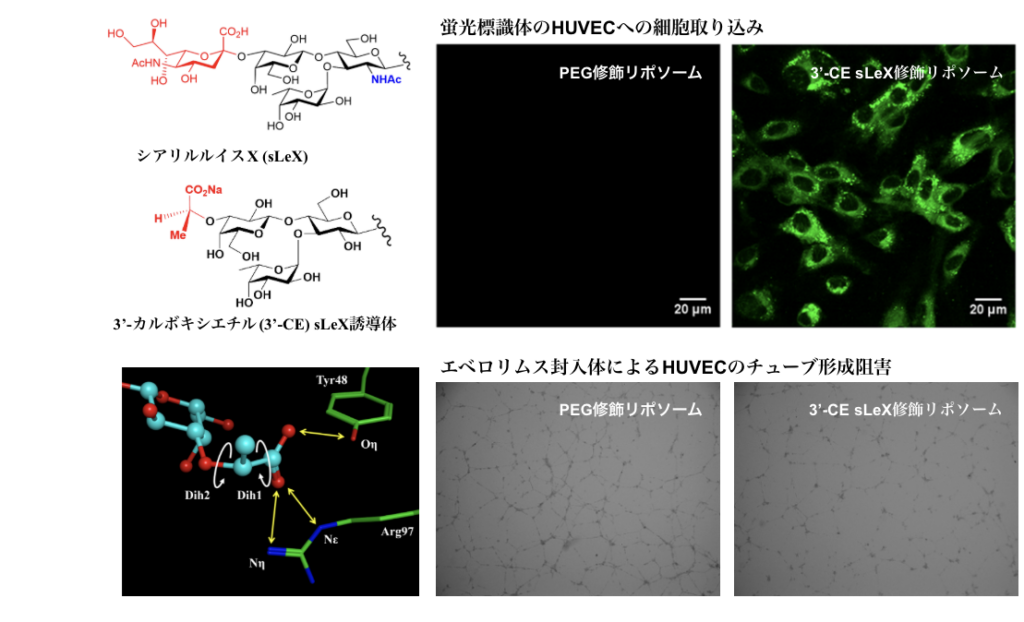
(図1 構造単純化シアリルルイスX修飾リポソームは細胞内へ効率よく取り込まれる:ヒト炎症血管細胞での実験)
山下教授らのグループは、薬物の生体内での動態を評価する技術開発も行っている。例えば、生きたマウスの肝臓や腸での血行状態は顕微鏡で観察しようとしても、呼吸や蠕動運動により臓器が振動し、観察できない。そこで、同グループの樋口ゆり子准教授は、マウス腹部を小切開して露出させた肝臓などを吸引固定する観察用デバイスを考案した。このデバイスでは、接着剤での場合とは異なって組織を何度も固定し直せるため、観察部位を自由に調節して内臓組織や血流を鮮明にとらえることができる。
同デバイスが効果を発揮した実例として、肝臓血管内の観察研究が挙げられる。量子ドットで標識した幹細胞を静脈注射すると、肝臓血管内で幹細胞が血流に乗って流される様子や血管内皮上でころころと転がるロ―リング現象を観察することができた。動物個体内で起こる局所での細胞の動きを詳細に研究することは、「細胞医療・再生医療において、機能を持った細胞自身の表面を修飾して標的組織に運び、そこに効率的に集積させる技術を開発する狙いがある」と山下教授は説明する。
山下教授、樋口准教授らが、最近、注力している研究が、間葉系幹細胞の標的指向化技術だ。ヒト間葉系幹細胞は、再生・細胞医療の原細胞として組織の再生や疾患治療に用いられ始めている。間葉系幹細胞の全身投与は、急性移植片対宿主病に対する免疫調節の目的に限られるが、将来内臓疾患や全身性疾患などに適用しようとする場合には標的組織に十分な量を集積させる技術が重要となる。
細胞接着を増強する細胞膜修飾の手段として、ポリエチレングリコール(PEG)をリンカーとする標的リガンド修飾PEG脂質を合成し、細胞と混合することでリガンド分子を表出させる方法がある。山下教授らは、炎症血管に高発現する接着分子ICAM1に着目し、ICAM1結合ペプチドを表出させた間葉系幹細胞を作製した。炎症血管細胞を培養したマイクロ流路内において動的相互作用をリアルタイムイメージングしたところ、ICAM1結合ペプチドで表面修飾した間葉系幹細胞の移動速度は遅く、流体場での接着が増強されることが確認されている。
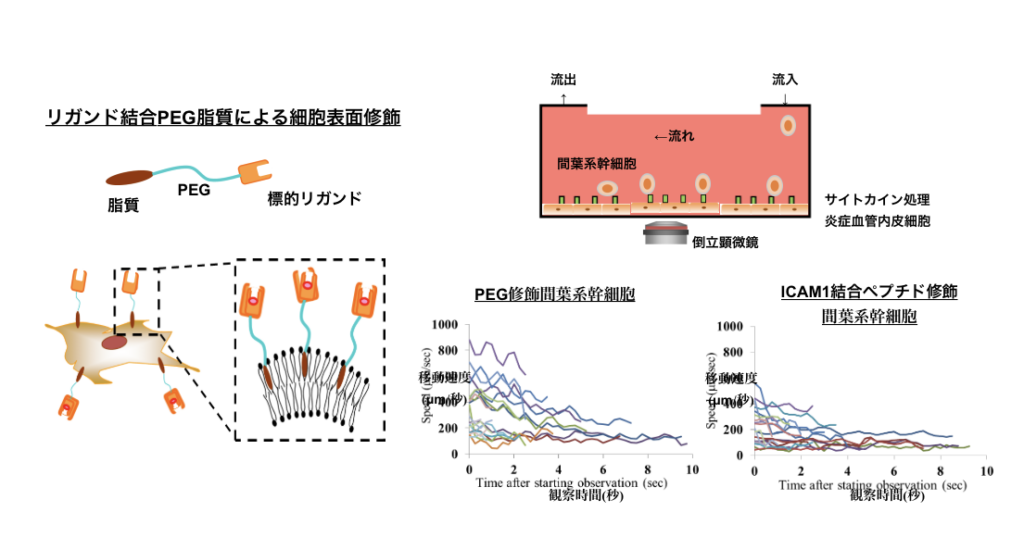
(図2 リガンド結合PEG脂質による表面修飾により細胞の動態を制御する:マイクロ流路での細胞間相互作用実験)
山下教授らは、さらに強固な細胞接着を得るために、低分子抗体を利用した細胞表面修飾を検討している。低分子抗体とは、抗体の重鎖と軽鎖の可変領域をリンカーで繋いだ単鎖可変領域フラグメント(scFv)やラクダ科動物から見出される重鎖抗体の可変領域ドメイン(VHH)抗体である。低分子抗体は、完全長抗体と同様に高い抗原認識能を持ちながら、大腸菌で発現生成できるので取り扱いやすい。だが、表面修飾のための化学合成にあたっては、低分子抗体に複数のPEG脂質が結合しない、とりわけ抗原認識能を損なわないようにすることが必要である。
山下教授らは、理化学研究所・坂本健作博士との共同研究により、非天然アミノ酸のアジドフェニルアラニンを低分子抗体に部位特異的に導入することに成功した。アジドフェニルアラニンはアジド基を有し、クリック反応を介して安定した結合を生み出せる。こうしてE-セレクチンに対するscFvのC末に導入したアジド基との反応を介してscFv-PEG-DSPEを創製し、幹細胞とインキュベーションすることでscFv修飾細胞を作製した。ICAM1結合ペプチドでの実験と同様、マイクロ流路に蛍光標識したscFv修飾細胞を一定速度で流すと、炎症血管内皮細胞上に多くの細胞が接着した。その接着の状態はICAM1ペプチドの場合よりも強固であり、低分子抗体の高い選択性と標的結合能が細胞の表面修飾に適していることが示された。
山下教授は「創薬モダリティーの高機能化が進むほど、膜透過や代謝など薬物動態学的な問題が深刻になり、DDS開発の必要性とその障壁が各段に増している」と述べ、これまで以上にピンポイントに標的を指向するDDSや、細胞のような機能体を運ぶDDSの開発に力を注ぐ方針で、今後も肝疾患治療を中心に積極的に取り組む構えだ。一方、「医療の個別化が叫ばれているなか、個体間差をうまく吸収するようなone-fits-all DDSの開発も必要となろう。ナノサイズの自律系はどうすれば作れるのやら…」と関心の尽きない様子だ。


