塩野義製薬は24日、抗インフルエンザウイルス薬ゾフルーザについて、「12歳以上のインフルエンザウイルス感染曝露後予防」を追加適応として、FDAより承認を取得したと発表した。同適応症は、提携先であるロシュグループが申請したもので、日本国内P3試験(BLOCKSTONE試験)の結果をもとに判断されたもの。なお、FDAの審査終了目標日(PUDUFA date)は本年11月23日であった。
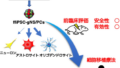
BLOCKSTONE試験では、「インフルエンザウイルス感染患者のいる家族または被験者に被検薬を投与したときの投与後10日の間にインフルエンザウイルスに感染し、発熱かつ呼吸器症状を発現した被験者の割合」を主要評価項目として、ゾフルーザの1回経口投与によるインフルエンザウイルス感染症の発症抑制効果を検証している。
インフルエンザウイルスに感染し、発熱かつ呼吸器症状を発現した被験者の割合は、ゾフルーザ投与群で1.9%、プラセボ投与群で13.6%であった。安全性に関しては、ゾフルーザは良好な忍容性を示し、安全性上の新たな懸念はなかった。
BLOCKSTONE試験結果は、New England Journal of Medicineの本年7月8日号に掲載されている。
ゾフルーザの開発および販売は、ロシュグループとの提携下で進めており、日本と台湾における販売は塩野義製薬が、それ以外の国ではロシュグループが行う。
米国では「12歳以上の合併症のない発症後48時間以内の急性のインフルエンザウイルス感染症治療」および「12歳以上の合併症を併発するリスクが高い患者の発症後48時間以内の急性のインフルエンザウイルス感染症治療」の適応でFDAから承認されている。
また、新型コロナウイルスと季節性インフルエンザの同時流行が懸念される2020/21シーズンにおいても、米国疾病予防管理センター(CDC)のガイドラインにおいて、ゾフルーザはインフルエンザウイルス感染症患者に対する治療薬として推奨されている。
米国における「1歳以上12歳未満の合併症のない発症後48時間以内の急性のインフルエンザウイルス感染症治療、および1歳以上12歳未満のインフルエンザウイルス感染曝露後予防」の適応については、ロシュグループが引き続き、FDAとの協議を進めていく。
また、欧州においては、欧州医薬品庁(EMA)の医薬品評価委員会(CHMP)より、「12歳以上の合併症のないインフルエンザウイルス感染症治療」および「12歳以上のインフルエンザウイルス感染曝露後予防」を適応症として、存じます。の承認を推奨する肯定的な見解が発表されている。
なお、同件が2021年3月期連結業績に与える影響は軽微である。
タイトルとURLをコピーしました