ロート製薬は16日、大阪大学と共同研究している「目の再生医療」につながる研究成果として、iPS細胞から作製した様々な眼の細胞を含む細胞群から、角膜上皮細胞のみを純化する新たな方法を確立したと発表した。同研究は、大阪大学大学院医学系研究科の林竜平寄附講座教授(幹細胞応用医学寄附講座)、西田幸二教授(眼科学、先導的学際研究機構 生命医科学融合フロンティア研究部門)、柴田峻共同研究員(ロート製薬、幹細胞応用医学寄附講座)らの研究グループが実施しているもの。
研究グループは、それぞれの眼の細胞の種類ごとに、基底膜タンパク質ラミニンに対して、接着性や増殖性の違いを見出し、角膜上皮細胞の純化に応用した。同成果により、外傷や病気により、角膜上皮の幹細胞が失われた難治性角膜疾患に対する新たな再生医療として期待される。具体的には、iPS角膜上皮細胞シート移植治療の普及や産業応用に向けたiPS角膜上皮細胞の単離法・細胞シート製造の簡便化・効率化・コスト削減等に寄与する。 同研究成果は、米国科学雑誌『Stem Cell Reports』に 4 月 14 日(3 月 19 日オンライン先行掲載)に掲載された。
iPS細胞は、理論上無限に増殖可能であり、身体を構成する様々な細胞に分化可能なため、再生医療や創薬研究、発生研究に非常に有用な細胞である。林竜平寄附講座教授らのグループは、これまでに、ヒトiPS 細胞から眼全体の発生を模倣した2次元培養系を用いて、様々な眼の細胞を含む多層状コロニー(SEAM)を誘導し、機能的な角膜上皮組織(iPS 角膜上皮細胞シート)の作製に成功している(Nature 2016)1)-2)。 今後、iPS 細胞を利用した再生医療技術を実用化・普及していくには、治療等に用いる目的の細胞のみを純化する工程の確立や効率化が非常に重要になる。iPS角膜上皮細胞シート移植治療においても、様々な眼の細胞を含むiPS由来の細胞の中から、角膜上皮細胞のみを単離・純化する工程が必須である。
これまで、角膜上皮細胞の選別・分取には、蛍光活性化セルソーティング(FACS)という技術が用いられてきたが、機器の費用が高く、その管理や使用には熟練した経験や知識を要することから、製造での使用はコスト・生産効率等の面において課題があった。
同研究では、大阪大学 蛋白質研究所の関口清俊 寄附研究部門教授らのグループにより作製されたE8 断片と呼ばれるインテグリン結合部位をもつ特殊な組換えラミニンアイソフォームが用いられた。研究グループはまず、iPS細胞から分化した様々な眼の細胞のうち、角膜上皮細胞が短時間で接着しやすいラミニンアイソフォームを調べたところ、角膜上皮細胞は、短時間において、特にラミニン 332、411、511 に特異的に接着しやすいことが判った。
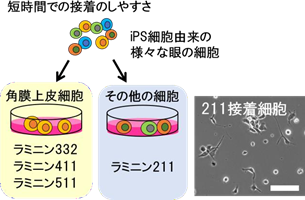
角膜上皮細胞はラミニン 332、411、511 に接着しやすく、その他の細胞はラミニン 211 に接着しやすい。ラミニン 211 に接着した細胞は、突起を伸ばすような非上皮細胞が多い。(スケールバー:100μm)
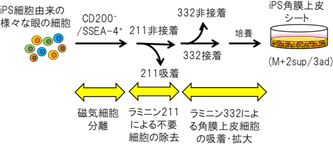
一方、ラミニン211 に対しては、角膜上皮細胞以外の、角膜上皮細胞シートを作製する上で不要な非上皮細胞の接着が容易であると判明した。これらの結果より、ラミニン211 は目的外細胞の吸着に用いる可能性が示唆されました(図2)。
また、この選択的接着性には、角膜上皮細胞を含む上皮細胞のみに発現するインテグリンβ4の関与も明らかにした(図3)。
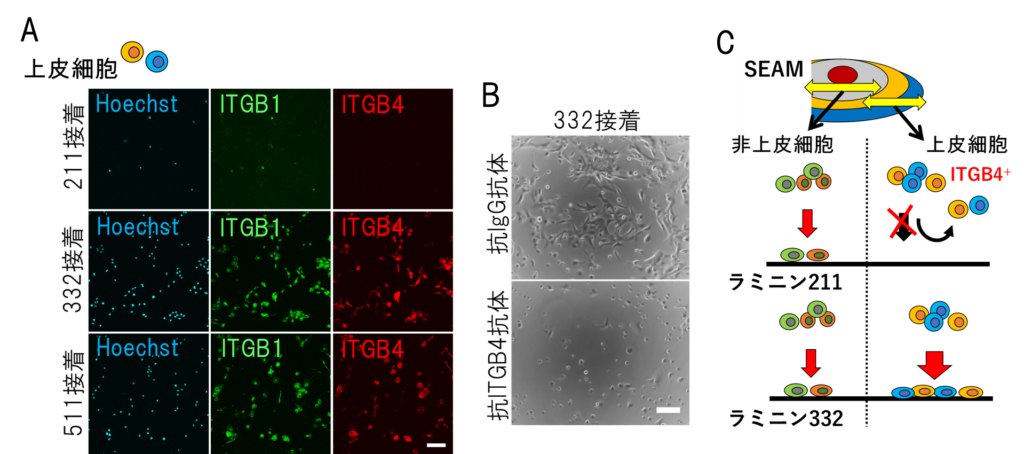
(A)短時間で各ラミニンに接着した上皮細胞のインテグリン(青:核、緑:ITGB1、赤:ITGB4)の発現。ラミニン 211 にはITGB4 陽性細胞は接着しない。(B)抗 ITGB4 抗体処理による上皮細胞のラミニン 332 への接着の減少。(C)非上皮細胞は一定の割合でラミニン 211、ラミニン 332 に接着する。一方、ITGB4 陽性の上皮細胞は、ラミニン 211 には接着せず、ラミニン 332 に短時間で効率的に接着する。
さらに、様々なラミニンの上でどの眼の細胞が増えやすいかを調べたところ、ラミニン 332 はiPS 角膜上皮細胞の増殖を促進し、その他の眼の細胞の増殖は促進しないことが判った(図4)。以上により、ラミニン332は、 iPS細胞から生成した様々な眼の細胞のなかでも、特に角膜上皮細胞の接着・増殖を促すことが明らかになった。
また、研究グループは、意図的にiPS由来の角膜上皮細胞中に、角膜上皮以外の目的外細胞を10%程度混入させ、様々なラミニン上で培養する実験を行った。同実験では、ラミニン 332上で培養した場合は、角膜上皮細胞のみが選択的に増殖を促され、その結果、増殖した角膜上皮細胞により目的外の細胞が押し出される、細胞競合現象の惹起を発見した。
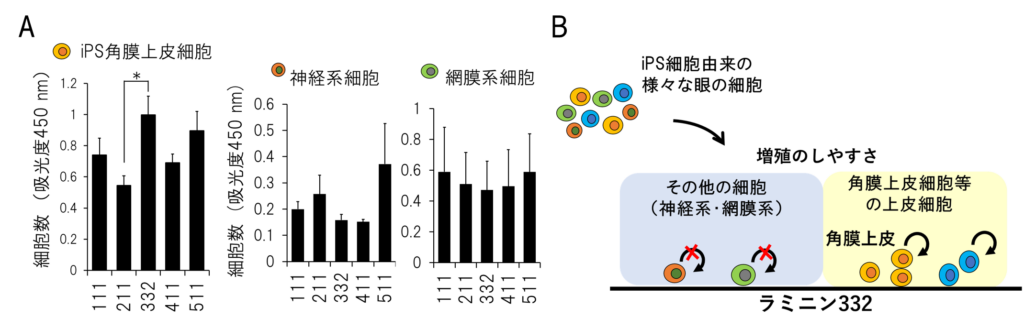
(A)iPS 細胞から誘導した角膜上皮、神経、網膜細胞を各ラミニンに同じ細胞数を撒き、数日間培養後に定量した細胞数を示す。(B) ラミニン 332 は、iPS 細胞から誘導した様々な眼の細胞のうち、上皮細胞のみを増やしやすい足場であることがわかった。
角膜上皮細胞シートを作製する際に、角膜上皮以外の細胞が混入してしまった場合でも、ラミニン332を用いた培養により、角膜上皮細胞のみの増殖や細胞競合を促し、不要な細胞を淘汰できる可能性が示唆された。
研究グループは、これらラミニンに対するそれぞれの眼の細胞が有する特徴と磁気細胞分離を組み合わせて、新たな角膜上皮細胞の単離・純化工程を確立した。すなわち、iPS 細胞から作製した眼の細胞から、磁気細胞分離により角膜上皮細胞を濃縮後、ラミニン211に播種して、不要な細胞を吸着させた後、細胞をさらにラミニン332に撒き直して培養することで高純度のiPS角膜上皮細胞シートが作製できた。
同研究成果により、角膜疾患治療のための新たな再生医療として期待されるiPS角膜上皮細胞シート移植におけるiPS角膜上皮細胞の単離工程の簡便化や大量生産・コスト削減を可能とし、治療法の普及を促進できる可能性がある。
また、再生医療に用いる細胞を単離するにあたり、ラミニンなどの足場の有効な利用法や、細胞の純化において細胞競合の応用可能性等について新たな知見を提供するものであり、今後の再生医療における、目的細胞純化について幅広い知見を提供できるものと考えられる。

