(P)RR機能調節に基づく新たな治療法開発に期待
岐阜大学応用生物科学部の海老原章郎教授らの研究グループは、膵臓がんの進展に関与するタンパク質・(プロ)レニン受容体[(P)RR]の作用部位をタンパク質構造予測人工知能(AI)ツールを用いて推定することに成功した。
(P)RRとは、血圧調節酵素レニンとその前駆体プロレニンに結合する一回膜貫通タンパク質として発見されたもの。その後の研究により、細胞の分化・増殖ならびにがんの進展に関与するWntシグナル関連タンパク質や、細胞内小胞の酸性化に寄与するV-ATPase複合体の構成因子など、様々なタンパク質との相互作用が報告されている。
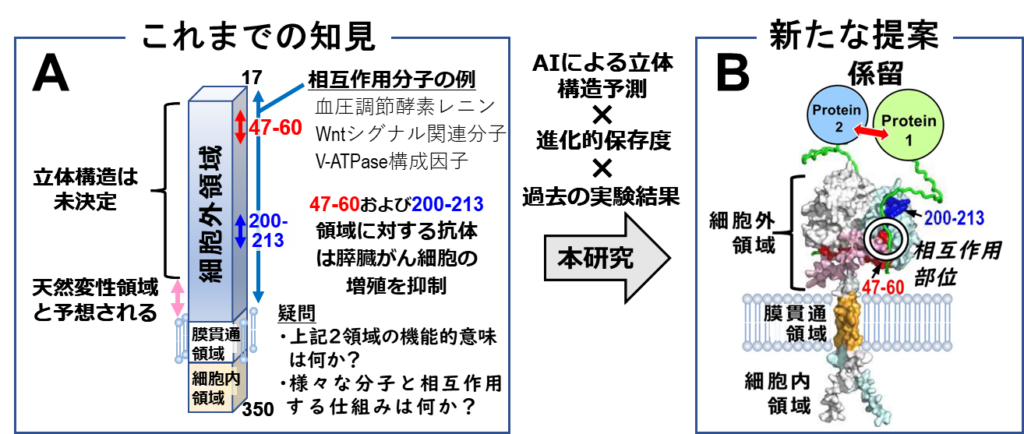
同研究グループはこれまでに、受容体細胞外領域上の特定領域2カ所に対する抗体がヒト膵臓がん細胞の増殖抑制を示し、特定領域の一つに対するモノクローナル抗体がWntシグナル伝達の抑制を介して実験動物でのヒト膵臓がんの進展抑制を示すことを明らかにしていた。
だが、それら特定領域の機能的な意味は未解明のままであった(図1A)。同研究では、2021年に公開された高正確な立体構造予測AIツールAlphaFold2を用いて(P)RRの立体構造モデルを独自に構築した。
解析の結果、膵臓がん進展に関与する上記特定領域と柔軟な構造を特徴とする天然変性領域注から形成される溝が受容体表面に存在することを突き止め、この溝がWntシグナル関連タンパク質との相互作用部位として機能すると提案した(図1B)。
同研究は、(P)RRの多機能性を生むメカニズムの理解や、がんを含む疾病に対する新たな治療法の開発に役立つものと期待される。これらの研究成果は、月9日に日本高血圧学会の欧文誌Hypertension Researchで発表された。
膵臓がんは、早期発見および治療が難しいことで知られている。膵臓がんでは、多くの遺伝子や染色体の異常が生じており、これが治療を困難にしている原因と考えられている。
一方、同研究の研究対象である(P)RRは、血圧調節酵素レニンとその前駆体プロレニンに結合する一回膜貫通タンパク質として発見されたが、その後の研究で、細胞増殖やがんの進展に関与するWntシグナル関連タンパク質や細胞内小胞の酸性化に寄与するV-ATPase複合体の構成因子など、様々なタンパク質との相互作用が報告されている(図1A)。
これらの相互作用タンパク質のアミノ酸配列には顕著な共通性は認められず、(P)RRが多様なタンパク質を広く認識し結合する性質を統一的に説明する仕組みは分かっていない。
これまでに、研究グループの香川大学・西山成教授らはWntシグナル依存的な膵臓がん進展において[(P)RR]が必須の役割を担うことを明らかにした。さらに研究グループは膵がん中和抗体の開発を目指して(P)RR細胞外領域に対するモノクローナル抗体(標的アミノ酸番号:200−213)を作成し、その抗体がWntシグナルの減衰を介し実験動物でのヒト膵臓がんの進展抑制を示すことを明らかにした。
その研究過程で、(P)RRの細胞外領域に位置する2領域(アミノ酸番号:47−60と200−213)に対する抗体がヒト膵臓がん細胞の増殖抑制を示すことを見いだしていた。この結果はそれら2領域がWntシグナル伝達に関係することを示唆しているものの、その機能的な意味は未解明であった(図1A)。
タンパク質は、アミノ酸がつながった紐のような物質として作られる。タンパク質は紐のままでは機能せず、アミノ酸配列(つながったアミノ酸の順序)に従って折りたたまれる。その際、アミノ酸番号が近い部分で局所的構造をとる場合もあれば、アミノ酸番号が離れた部分が3次元空間的に近接し機能部位注をつくる場合もある。
このような折りたたみを受けたタンパク質に関する立体構造情報は機能を知る上で大変有用であるが、その情報取得には通常、タンパク質を一つ一つ調製し実験的に構造を決定する必要がある。しかも実験的な構造決定には年単位の試行錯誤を要することもまれではない。
同研究着手当時、そして現在も、膵臓がん進展に関与する(P)RR細胞外領域の立体構造は実験的に解き明かされていなかった。
2021年、実験的構造決定に匹敵する高い正確性でタンパク質立体構造を予測できる人工知能(AI)ツールであるAlphaFold2とRoseTTAFoldがそれぞれ公開された。構造予測に必要な情報は目的タンパク質のアミノ酸配列のみで、それらAIツールを無料で利用可能なWebサイトを使って誰でも数時間の計算で構造を導くことが可能だ。
研究グループは、その高い予測確度と利便性に注目し、AIツールで予測した立体構造モデルによって上記2領域の機能的役割や(P)RRの多機能性(様々なタンパク質と相互作用する能力)を解明できるのではと考え、同研究を立案。その結果、次の研究成果を得た。
(1)予測構造に基づき膵臓がん細胞の抗増殖効果に関与する領域の特徴を明らかにした。
研究グループはまず、立体構造予測AIツールAlphaFold2で予測された(P)RRの立体構造モデル(図2A)の特徴を調べた。その結果、細胞外領域は折りたたまれた部分(アミノ酸番号:17−269)と折りたたまれていない部分(アミノ酸番号:270−296)からなると分かった。
(P)RRを細胞膜に固定する役割をもつ膜貫通ドメインは、これまでの知見通りの立体構造と性質(疎水性の表面を有するらせん構造)を示していた。
次いで研究グループは、AlphaFold2と同時に公開された別の立体構造予測AIツールRoseTTAFoldでも(P)RRの立体構造モデルを構築し、その予測構造がAlphaFold2による構造(図2A)とほぼ同じ特徴を有していることを確認した。
一般に、タンパク質機能において重要な役割を担うアミノ酸残基は3次元空間的に近接して機能部位を形成する。さらに、それらの機能上重要なアミノ酸残基は生物進化の過程で高度に保存され、ファミリーを形成するタンパク質群のアミノ酸配列を比較した際に計算される「進化的保存度」と呼ばれる指標が高いことが知られている。
そこで、膵臓がん細胞に対する増殖抑制を示す抗体が作用する領域(アミノ酸番号47−60および200−213)の3次元空間分布を、AlphaFold2による立体構造モデルを用いて調べた。
その結果、これら2つの領域は連続した表面部位を形成していた(図2B)。さらに、同構造モデルを各アミノ酸残基の進化的保存度で色分けしたところ、2つの領域、特に47−60残基領域の表面は進化的に高度に保存されていた(図2C)。
これらの結果から、膵臓がん細胞実験で見いだした重要領域(47−60および200−213)が、膵がん進展に重要なはたらきを担っていると分かった。
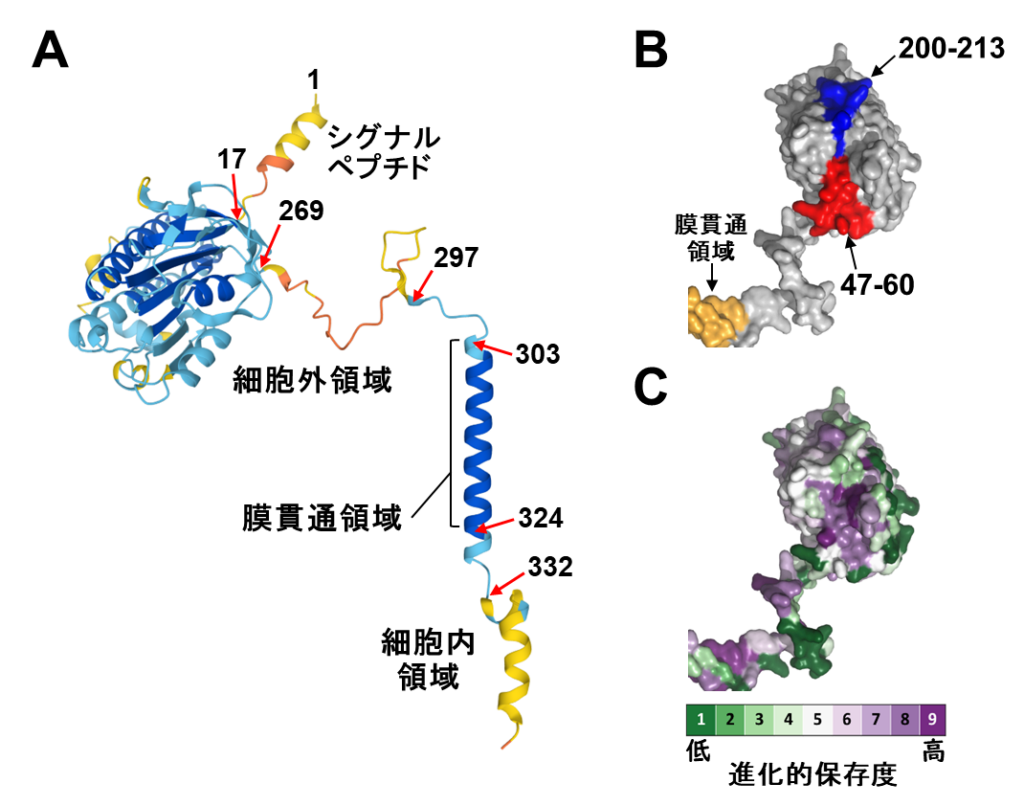
A: (P)RRの予測立体構造。(P)RRを構成する350アミノ酸残基に対して、予測信頼度が高い順に青、シアン、黄色、オレンジで色付けされている。番号はアミノ酸残基番号を示す。この予測構造はAlphaFold2データベースに登録番号AF-O75787-F1で公開されている。
B: 膵臓がん細胞の抗増殖効果に関与する2領域は連続した表面部位を形成する。アミノ酸番号:47−60を赤色で、200−213を青色で示す。
C: 進化的保存度で色分けした図。進化的保存度が高い残基を紫色で、保存度が低い残基を緑色で表した。2領域は進化的に高度に保存されていると分かる。
(2)立体構造予測AIツールで[(P)RR]がホモ二量体化する要因を明らかにした
これまでに研究グループは、(P)RRが細胞外領域を介しホモ二量体を形成することを明らかにしていた。そこで、立体構造モデルを使ってホモ二量体化の鍵となる細胞外領域を詳しく調べた。
その結果、細胞外領域の折りたたまれた部分(アミノ酸番号:17−269)は半球形を呈し、その平らな面は進化的保存度が高いアミノ酸残基で形成されていた(図3A)。そこで研究グループは、この平らな面がホモ二量体化形成に関わっているのではないかと予想し、AIツールAlphaFold2を用いて(P)RRのホモ二量体形成能を評価した。
その結果、予想通り、平らな面を背中合わせに2分子の(P)RRが二量体を形成した。
これを踏まえ、研究グループは全長ヒト[(P)RR](アミノ酸番号:17−350)に対するホモ二量体立体構造モデルを構築した(図3B)。
(P)RRのホモ二量体には、アミノ酸番号47−60と200−213からなる連続した表面部位が表と裏の2カ所に存在する。興味深いことに、ホモ二量体を構成する一方のタンパク質の折りたたまれていない部分(アミノ酸番号:270−296)が、他方のタンパク質の47−60領域の上に突出し、その領域上に“ふた”を形成していました(図3B)。“ふた”の部分は、研究グループの先行研究(アミノ酸配列解析)で推定していた天然変性領域に相当する。
一般に、天然変性領域はその構造の柔軟性から同じ領域を利用して複数のタンパク質と結合できることが知られている。現時点で(P)RRにおける天然変性領域のはたらきは報告されていないが、膵がん進展で着目した重要領域(47−60および200−213)と天然変性領域からなる“ふた”が立体的に近い位置に存在することから、両者の間には機能的関連性があると研究グループは考えた。
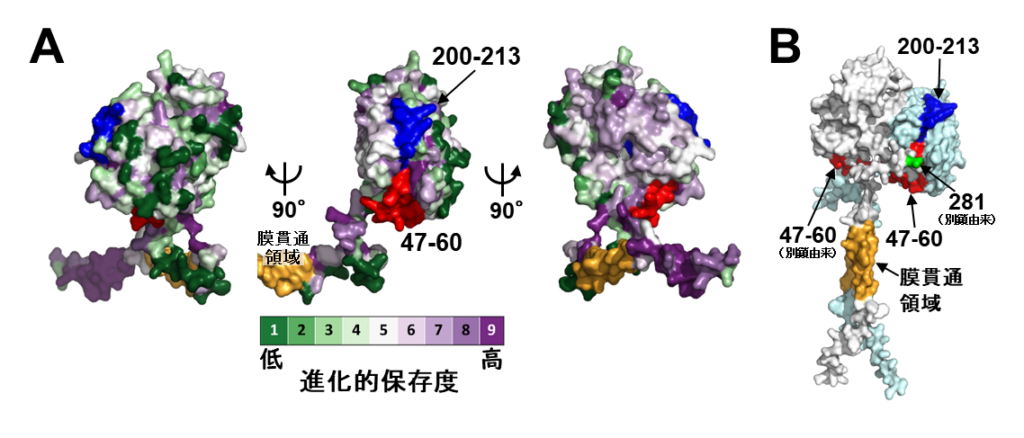
A: (P)RR細胞外領域を進化的保存度で色分けした図。折りたたまれた部分(アミノ酸番号:17−269)は半球形をなし、凸な面と平らな面を備えている(図中央)。中央をそれぞれ90度回転したものを左と右に示した。平らな面は薄紫色、すなわち進化的保存度の高いアミノ酸残基で構成されていると分かる。
B: 全長ヒト(P)RR(アミノ酸番号:17−350)に対するホモ二量体立体構造モデル。2つの(P)RRタンパク質を灰色とシアン色で、膜貫通領域を黄色で表示している。膵臓がん細胞に対する増殖抑制を示す抗体が作用する領域(アミノ酸番号:47−60および200−213)をそれぞれ赤と青で示す。
(3)ホモ二量体構造に基づきタンパク質相互作用部位を推定した
構造モデルを詳しく調べた結果、細胞外領域には手のような形をした溝が存在することが分かった(図4A)。手のひらは膵臓がん細胞抗増殖効果に関与する2領域(アミノ酸番号:47−60と200−213)に相当し、表面には疎水性の性質を示す進化的に保存されたアミノ酸残基が配置されていた。その特徴より、特異的結合(一対一結合)ではなく、様々なタンパク質を広く認識する相互作用(一対多結合)が想定される。
一方、指は天然変性領域からなる柔軟な“ふた”に相当し、天然変性領域の特徴から複数のタンパク質と結合できる一対多結合が考えられる。つまり[(P)RR]は、ホモ二量体形成によって手の形をもつ溝を2カ所生み出し、この溝がタンパク質相互作用部位として機能する可能性、そしてその作用部位はこれまで未解明だった一対多結合を統一的に説明しうる特徴を備えていることを研究グループは突き止めた。同研究が提案する作用機構は次の通り。
これまでの知見よりWntファミリータンパク質の一つWnt3aは関連タンパク質であるFZD8とLRP6(図4B)の両者に結合し、シグナルを細胞内に伝える。
一方、(P)RRは細胞外領域を介しWnt非依存的にFZD8とLRP6と相互作用すると判明している。(P)RRは、上述の溝を作用部位としてWnt非依存的にFZD8とLRP6を結合し、それらを空間的に近くなるよう係留する足場タンパク質注として機能すると考えられる。
そのような結合・係留機構はWntシグナルへの効果的な応答を実現するために有利であると考えられる。
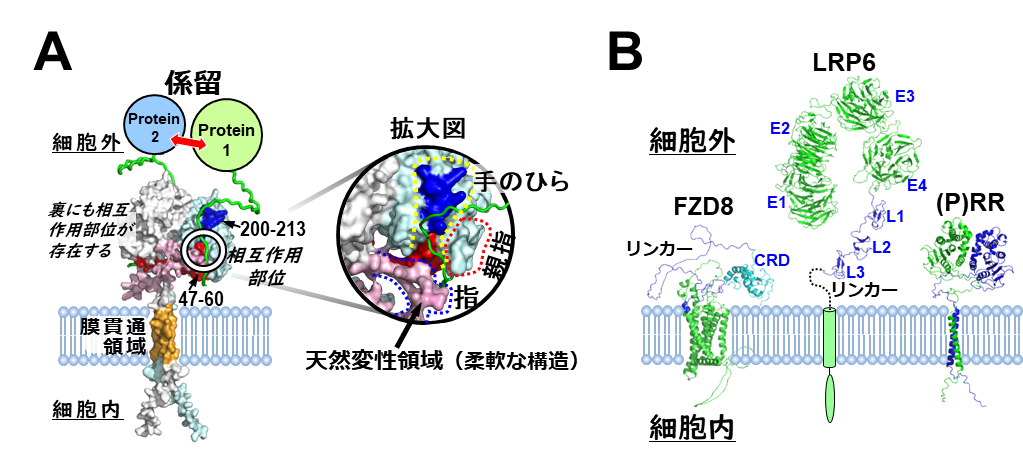
A: 見いだした(P)RRのタンパク質相互作用部位。受容体細胞外領域上に手のような形をした溝が存在し、この溝で(P)RRはタンパク質を結合・係留すると考えられる。
B: 細胞膜上における(P)RRとWntシグナル関連タンパク質(FZD8とLRP6)との位置関係。
同研究では、立体構造予測AIを進化的保存度と過去の実験結果を融合し、(P)RRの作用部位を推定した。さらに(P)RRがこの部位でWntシグナル関連分子を含む様々なタンパク質を広く認識し、それらを結合・係留する足場タンパク質として機能すると提案した(図4A)。
今後は、(P)RRと様々なタンパク質分子との間の相互作用を詳細に調べ、(P)RRの多機能性を支える相互作用能力(一対多結合)を実験的に検証することが必要である。
その仕組みが解明できれば、(P)RRが関与する高血圧や膵臓がん等の疾病発症の解明に加え、中和抗体を含む(P)RRの機能調節に基づく新たな治療法の開発に役立つものと期待される。
さらには、従来の「模式図生物学」(図1A)からAI活用による「実体生物学」(図1B)への転換により、タンパク質機能の理解を深めた成功例として位置づけることができるのではないかと考えられる。


