糖尿病の根治治療への応用に期待
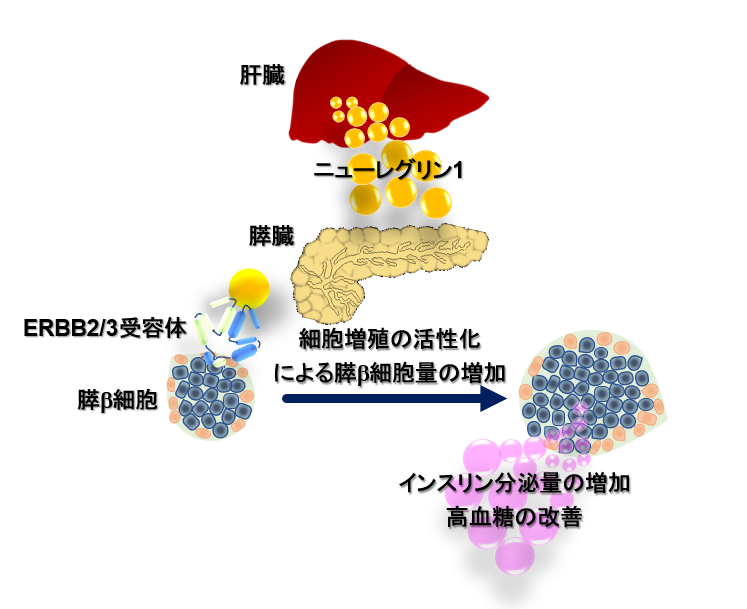
早稲田大学理工学術院の合田亘人教授、大阪公立大学大学院医学研究科肝胆膵病態内科学河田則文教授らの研究グループは、糖尿病の根治に必要不可欠なインスリン分泌細胞(膵β細胞)の細胞量を増やす肝臓から分泌されるタンパク質(ヘパトカイン)のニューレグリン1を同定することに成功した。
糖尿病は、高い血糖値を特徴とする慢性疾患である。2023年、世界の糖尿病患者数は5億3000万人にも上り、2045年には7億人を突破し、10人に1人が糖尿病に罹患する状況になると予測されている。糖尿病の原因は、血糖値を下げる唯一のホルモンのインスリンが十分に働かないことにある。これまでに血糖値を下げる薬が数多く開発されてきたが、未だ糖尿病を根治できる薬は存在しない。
糖尿病の根治には、インスリンを分泌できる膵β細胞の量を増やすことが必要となる。そのために、体の中で膵β細胞の量を安全に増やすことができる分子の探索と、その作用発現の分子機構の解明が重要である。同研究成果は、本年3月13日に「Nature Communications」のオンライン版で公開された。
慢性的な高血糖を特徴とする糖尿病では、病態の進行に伴って血糖値を下げることができる唯一のホルモンのインスリンを分泌する膵β細胞の量が減少する。そのため、体内のインスリンの働きが悪くなり、正常な血糖値を維持することができない。
既存の糖尿病治療薬は、血糖値を下げることを目的としている対処療法である。つまり、糖尿病患者は一生薬を服用し続ける必要がある。糖尿病の根治療法は、インスリン分泌の能力を持った膵β細胞の量の回復が必須であるが、これを実現できる治療薬は未だ開発されていない。
肥満を背景に発症する2型糖尿病患者の場合、糖尿病と診断される前からインスリンの作用を強めるために膵β細胞の量が代償的に増えることが分かっている。これまでの研究から、肝臓から分泌される因子、近年ではヘパトカイン ※1と総称される分子が、生体防御機構とも言えるこの現象にかかわっていることが分かってきたが、その実態はよく分かっていなかった。
今回の研究では、2型糖尿病の発症過程において認められる生体防御機構としての“代償的な膵β細胞の量の増加”にかかわる肝臓由来の分泌因子、所謂、ヘパトカインを同定することを目指した。
具体的には、脂肪と糖質が豊富に含まれる食餌をマウスに15週間投与して、ヒトの2型糖尿病に類似した病態、つまり肥満を背景に2型糖尿病を発症するようにした。膵β細胞が局在する膵島(ランゲルハンス島)の大きさが食餌投与後にどのように変化するのかを組織切片を作成して経時的解析に重視した。
その結果、食餌投与10週目までは膵島のサイズに大きな変化がなく、投与15週で急激に大きくなることを見いだした。
次に、食餌投与前、投与10週目と投与15週目の肝臓の遺伝子の発現量を網羅的に解析した。そのデータを用いて、3つの条件、1)食餌投与前と比較して投与10週目の肝臓で遺伝子の発現量があまり変化しない遺伝子、2)食餌投与前と比較して投与15週目の肝臓で遺伝子の発現量が大きく変化する遺伝子、3)分泌 される可能性がある遺伝子を設定して140の候補遺伝子を絞り込んだ。
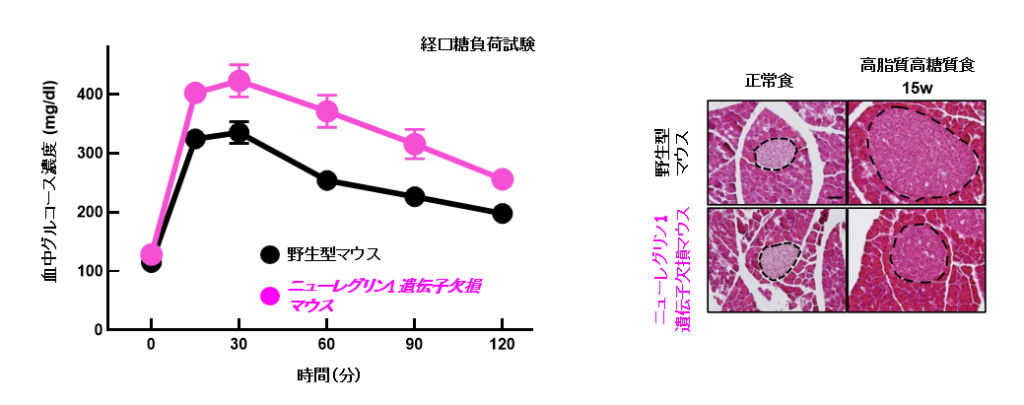
候補遺伝子を正常マウスの肝臓に過剰に発現し、膵島が大きくなるかどうかを組織学的に解析した結果、ニューレグリン1を見いだすことに成功した。実際にニューレグリン1が2型糖尿病で認められる代償的な膵β細胞の量の増加にかかわるのかについて、肝臓でニューレグリン1遺伝子を欠損させた2型糖尿病マウスを作出して解析した。
その結果、ニューレグリン1遺伝子を欠損させたマウスでは膵臓の肥大が抑制され、血糖値がさらに上昇することを見いだした(図1)。
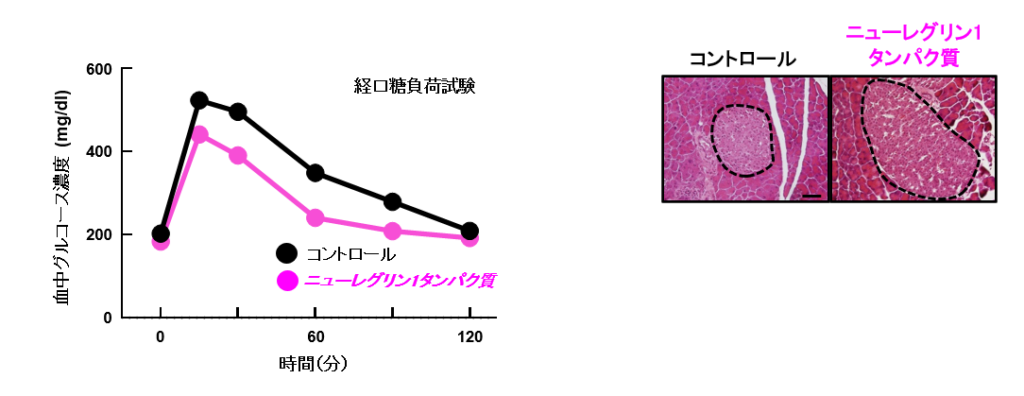
逆に、ニューレグリン1遺伝子を肝臓で過剰に発現すると、膵臓の肥大が増強して血糖値が下がった。また、ニューレグリン1タンパク質を肥満・2型糖尿病モデルマウスに投与しても同様の改善効果が認められた(図2)
さらに、ニューレグリン1の作用は膵臓のERBB2/3受容体と、細胞内MEK/ERKシグナル系を介した膵β細胞の細胞増殖の活性化によるものであることも明らかにした。最後に、代謝異常関連脂肪性肝疾患(MASLD)患者集団の解析を行い、BMI30以上の患者では血中ニューレグリン1タンパク質濃度が高くなること、一方で2型糖尿病を発症するとその濃度が低下することを見いだした(図3)。
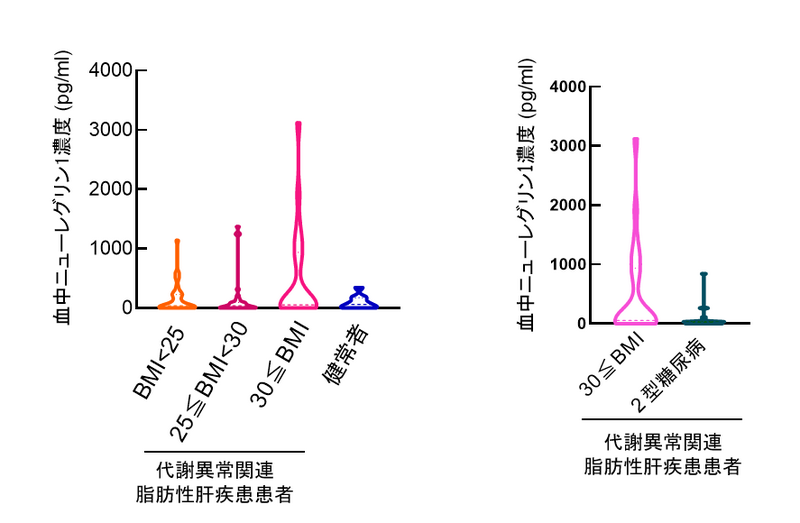
この結果は、ニューレグリン1がヒト膵β細胞の量の調節にかかわる可能性や、血中ニューレグリン1タンパク質濃度が低下している2型糖尿病患者にニューレグリン1の補充療法が糖尿病の改善をもたらしうる可能性があると考えられる。
これまでに糖尿病を根治できる治療薬は開発されていない。糖尿病の根治には、インスリン分泌能力を持った膵β細胞の量を回復することが必要である。今回発見したニューレグリン1は膵β細胞の量を回復する作用を示すタンパク質だ。
欧米人と比較して、アジア人、特に日本人はインスリン分泌能力が低く、糖尿病を発症しやすい人種である。2型糖尿病患者で血中ニューレグリン1濃度が低かったことから、ニューレグリン1の補充療法が膵β細胞の量を回復し、糖尿病を根治できる可能性がある有望な方法になりうると考えられる。また、血中ニューレグリン1濃度が糖尿病発症を予見できる新しいバイオマーカーとして使える可能性もある。
今後は、ニューレグリン1がヒトの膵β細胞の増殖を活性化できるのか、また2型糖尿病だけでなく1型糖尿病の膵臓に対してもその作用が認められるのか検証が必要となる。ニューレグリン1を標的とした治療薬の開発はその安全性の検証のみならず、膵β細胞への指向性をどのように担保すべきかを考慮しなければならない。だが、マウスを用いた研究成果がヒトでも同じような効果をもたらすことができれば、糖尿病の根治療法になり得る可能性がある。
◆研究者のコメント
本研究で着目したニューレグリン1は、膵β細胞に直接働きかけ、その細胞量を増やすことができる分子であり、ニューレグリン1が糖尿病の根治治療標的になりえる可能性を秘めている。
期待した通りの効果がヒトでも認められれば、糖尿病根治への道を拓くことができると信じている。


