
東北大学大学院医学系研究科(分子内分泌学分野)の菅原明氏らの研究グループは、既存薬剤薬とは異なる作用メカニズムを有するChREBP活性阻害薬の糖尿病性腎症治療剤の開発に向けた研究加速を目的としたクラウディングファンディング(https://readyfor.jp/projects/tohoku-ChREBP?sns_share_token=&utm_source=pj_share_url&utm_medium=social)を開始した。
クラウドファンディングの目標金額は800万円で、寄付募集は12月20日午後11:00まで。現在、寄付総額202万9000円、寄付者120人、残り70日。
日本の糖尿病人口は、その予備軍も含めると2000万人以上とされている。血糖値が高い状態が続けば、全身にさまざまな症状を引き起こす糖尿病。その糖尿病の3大合併症のひとつに、腎臓の機能が悪化する「糖尿病性腎症」がある。
糖尿病で血糖値が高い状態が続くと、腎臓の毛細血管(糸球体)が壊れてしまって腎臓のはたらきが徐々に失われていく。糸球体に負担がかかると、タンパク尿の出現や糸球体濾過量(GFR)の低下がみられるようになり、最終的には末期腎不全に至る。末期腎不全まで進行すると、人工的に血液中の老廃物や余分な水分を取り除くための透析療法が必要となる。
糖尿病性腎症は、第一期、第二期ではゆっくりと進行し、第三期、第四期は早く進行し、第五期で透析が必要となる。透析まで糖尿病性腎症が進行しないようにその進行を食い止める新しい薬剤の開発が期待されている。
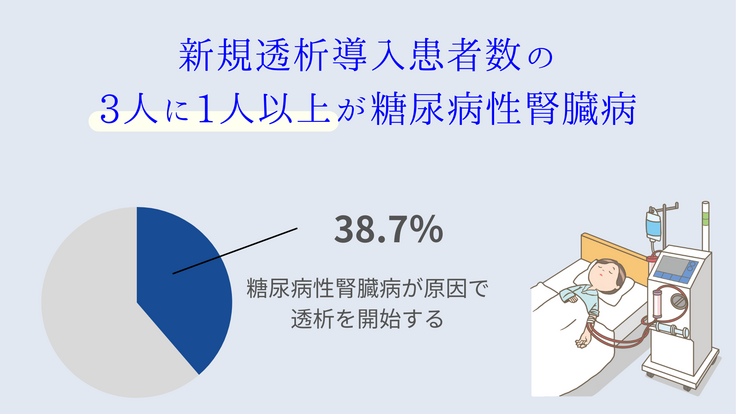
透析療法を開始する患者のうち、糖尿病性腎症が原因である患者は3人に1人以上を占めている。近年の新薬開発で、血糖コントロールは以前より容易になってきたが、糖尿病に特有な合併症である細小血管症の治療薬の開発はまだまだ不十分である。
糖尿病性腎症でこれまで頻用されてきたACE阻害薬やARBは、輸出細動脈を拡張して糸球体内圧を低下させることで、糸球体の負担を軽減させる薬剤である。また、最近注目されているSGLT2阻害剤は、血糖降下作用を有する糖尿病治療薬であるが、輸入細動脈を収縮させて糸球体内圧を低下させる作用があり、糖尿病性腎症の治療薬としても着目されている。
一方、これまで糖尿病性腎症の治療薬開発が十分に行われていない背景としては、同疾患は様々な要因が複雑に絡み合っているため開発が難しいかった理由が挙げられる。とはいえ、糖尿病性腎症は既存の治療薬のみではその進行を食い止めることが困難であるため、新規治療薬の開発が待ち望まれている。
こうした中、菅原氏ら研究グループは、既存薬とは異なる作用メカニズムを持つ糖尿病性腎症治療薬の開発に着手した。菅原氏らは、糖質応答転写因子 ChREBP(Carbohydrate response element binding protein)に着目し、薬剤の開発を進めている。転写因子は、遺伝子からタンパク質をつくる「転写」を制御することで、体内の細胞のはたらきを変化させている。ChREBPは、高血糖刺激により活性化され、糖代謝、脂質合成系や酸化ストレスに関与する遺伝子の発現調節を行い、恒常性の維持に関わっている。
菅原氏らの研究グループは、これまでChREBPを欠損したノックアウトマウスを作成し、ストレプトゾトシンという薬剤で糖尿病を発症させたところ、通常(野生型)のマウスでは糖尿病性腎症が発症したのに対し、ChREBP欠損マウスではその発症が阻止された(菅原他、未発表データ)。この実験結果からChREBPが糖尿病性腎症の発症・増悪に関与している可能性が示され、ChREBPの活性を抑制する薬剤の開発に着手した。
転写因子ChREBPは、グルコースに応答して核内移行し、核内に移行したChREBPは、解糖系・脂肪酸合成系の調節酵素であるL-PK、ACC、FASなどの遺伝子発現を促進させる。その活性化メカニズムは、リン酸化、脱リン酸化により制御されていると考えられている。
その後の菅原氏らの研究により、ChREBPの活性化阻害薬である「D532」が東北大学化合物ライブラリーのハイスループットスクリーニングから同定された。D532は、動物実験において、1型ならびに2型糖尿病モデルマウスに対して、著明な尿タンパク減少効果、腎機能改善効果ならびに腎病理組織改善作用を示した(菅原他、未発表データ)。
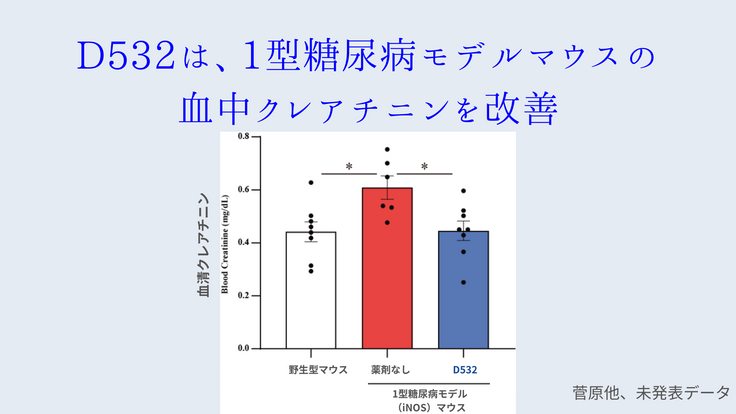
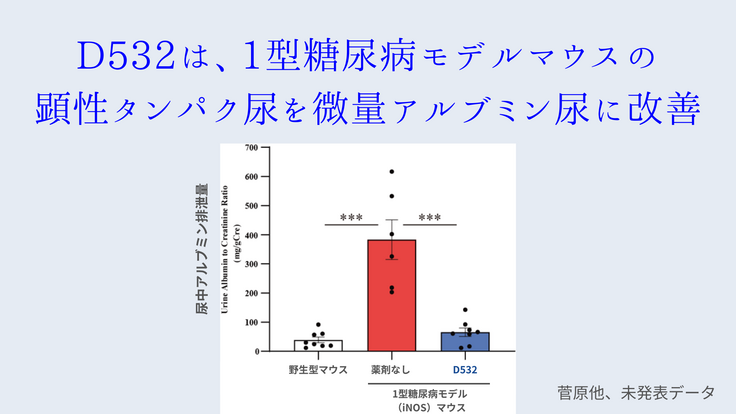
これらの実験結果は、D532が将来的に新規糖尿病性腎症の治療薬となり得る可能性を示している。だが、現時点ではまだまだ臨床応用に至るまでにクリアしなければいけない点が数多くあり、今回のクラウドファンディングを通した寄付により、①D532の構造変換により、効果の高い副作用などが起きにくい薬剤を作成する、②作成した新規化合物のマウス体内のおける薬物動態を明らかにする、③新規化合物の作用する臓器並びに作用メカニズムを遺伝子レベルで明らかにするーの順で前臨床・基礎研究を進めていく。
実用化に向けてはまだまだ多くの検証が必要であり、現在は動物実験段階であるが、糖尿病性腎症治療薬にこの新薬が加わることができれば治療選択肢が確実に拡大する。
菅原氏は、「ARBやSGLT2阻害薬などの既存薬と併用治療を行うことで、糖尿病性腎症の増悪・進展が抑えられると考えている。また、この治療薬を早期から糖尿病患者さんに投与することで、糖尿病性腎症の発症も抑制できる可能性がある」と説明する。
その上で、「これらの目標に向け、本クラウドファンディングへのご寄付をもとに十分なデータが得られると前臨床試験、臨床治験へとスムーズに進めていけるものと期待している。将来的には、いずれかの製薬企業とのコラボレーションまたは導出を行って、新しい作用機序の糖尿病性腎症治療剤を製品化したい」と抱負を述べ、クラウディングファンディングへの協力を求めた。
◆菅原明氏のプロフィール
東北大学医学部を卒業後、東北大学第二内科(腎・高血圧・内分泌科)で内分泌内科医としてキャリアをスタートさせた。大学院時代は東北大学第一医化学教室で糖尿病に関連した分子生物学の研究を行い、その後は米国のハーバード大学でホルモン核内受容体の研究を行ってきた。帰国後は、東北大学病院ならびに宮城県立がんセンターで内分泌代謝・糖尿病、腎・高血圧の臨床を行いながら、東北大学大学院医学系研究科(分子内分泌学分野)で内分泌・代謝領域の基礎研究を続けている。
◆クラウドファンディングの目標金額(800万円)の内訳
人件費:120万円
消耗品費:200万円
化合物合成費 :50万円
培養細胞・培地代:50万円
マウス購入・飼育代:80万円
外注費:88万円
クラウドファンディング手数料・諸経費など:212万円
※本クラウドファンディングはAll in方式で実施される。寄付総額が目標金額に達しなかった場合でも、集まった寄付金を研究活動へと活用する。その場合にも国の研究費などから財源を確保し、同プロジェクトページ記載の研究計画に沿って継続実施いする。
※なお、クラウドファンディング期間内に上記の目標金額を達成することができたら、第二目標金額を2000万円と設定し、引き続き糖尿病性腎症治療薬開発に向けた基礎研究・前臨床試験へと活用する。
※同研究の実施にあたり、動物実験委員会等の必要な承認は既に得ている。



