iCONMの内田ラボ(ラボ長:内田智士氏・主幹研究員/東京医科歯科大学難治疾患研究所教授)は、東京都医学総合研究所、東京医科歯科大学、杏林大学および NANO MRNAと共同で、殻でくるまないmRNA(裸のmRNA)の皮内投与によるSARS-CoV-2ウイルスに対する霊長類でのワクチン効果の実証に成功した。
mRNAは大変不安定な化合物で、脂質性ナノ粒子(LNP)など殻にくるんで投与することが不可欠とされてきた。今回報告する方法は、その常識を覆し、裸のmRNAを用いてSARS-CoV-2に有効性を示した世界初のmRNAワクチンとなる。全身性の有害事象とも関連する可能性が高いLNPを用いていないため、何度でも繰り返し気軽に接種できる安全なmRNAワクチンになることが期待される。
現在、臨床試験に向けた開発が進んでいる。詳細な研究成果は、日本時間で本年4月3日に国際的医学誌 Molecular Therapy でオンライン掲載された。同文は、オープンアクセス化しており、誰でも無料で入手できる。発表内容の要約は、次の通り。
・現在使われている mRNA ワクチンは脂質性ナノ粒子(LNP)などの殻でくるまれて投与されているが、そのLNPが副次的有害事象を発生させている可能性が高い。
・mRNAを殻で保護しない「裸のmRNA」からなるワクチンで、SARS CoV 2 (COVID 19)ウイルス感染症を予防することに、世界で初めて成功した。(mRNA ワクチンにはナノ粒子が不可欠という常識を覆した)
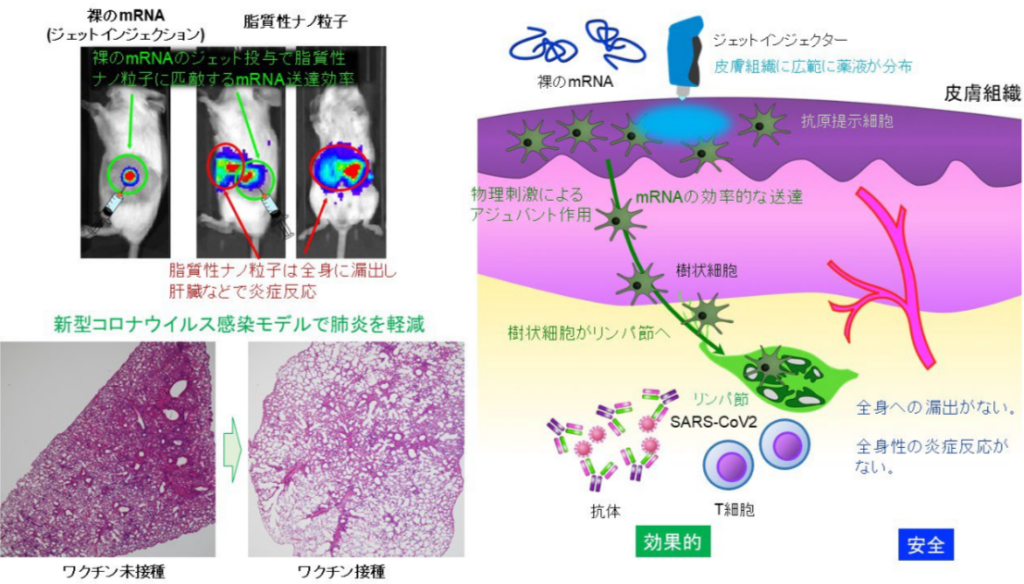
・ジェットインジェクターを用いて「裸のmRNA 」を皮膚組織内に投与する手法で、ワクチンの効果を飛躍的に向上できた。(筋肉組織よりも皮膚組織の方が、免疫細胞が多く存在する)
・マウスを用いた実験では、6カ月間に渡る抗原特異的抗体産生が観察された。
・霊長類のカニクイザルを用いても、マウス実験と同等のワクチン効果が確認できた。
・投与された「裸のmRNA 」は接種部位に留まるため、全身性の副次的有害事象は観察されなかった。
新型コロナウイルス感染症(COVID-19)のパンデミックに対して、mRNA ワクチンが優れた有効性を示し、世界中で何十億回と接種が行われた。だが、急速な開発の裏で課題も顕在化していて、特に、重篤なものを含む比較的強い副反応が大きな課題となる。
この副反応は、パンデミック時の数回程度の接種であれば許容されるものの、今後の COVID-19 に対する度重なるブースター接種や、他の感染症への mRNA ワクチンの適応を考えると、生涯にわたって数十回接種できるようなより安全性の高いプラットフォームが望まれる。現在使用されている mRNA ワクチンでは、mRNA を搭載している脂質性ナノ粒子(lipid nanoparticle : LNP)が、副反応の原因の一つとして挙げられている。LNPを構成する脂質は、免疫刺激性を持つほか、投与部位から漏出して全身に分布するため、全身性の炎症反応を惹起する。
一方で、LNPワクチンは、【機能 I】mRNA の分解を防ぎ、細胞内へ効率的に mRNAを送達する機能、【機能 II】リンパ節に移行し免疫細胞に mRNA を送達する機能、【機能 III】免疫刺激性脂質に起因する炎症反応が免疫系を刺激する機能といったワクチンの作用上重要な機能を有している、これらの機能を、LNPを用いることなく如何に再現するかが重要となる。
今回、最もシンプルで安全な設計である「裸の mRNA」の投与を検討した。【機能 II】に関して、現在のワクチンの接種部位である筋肉組織には免疫細胞がほとんど存在しない。そこで、免疫細胞がより豊富である皮膚組織を標的とした。
さらに、【機能 I】を補うために、圧を用いて mRNA 溶液を細胞内に送達できるジェットインジェクターを用いた。実際に、レポーター試験では、ジェットインジェクターを用いることで、mRNA の皮膚組織内への送達効率が 100 倍以上向上した。さらに、mRNA は投与部位に留まり、全身への漏出は確認されなかった。
一方で、mRNA搭載LNPは、皮内投与後、肝臓、脾臓など全身臓器へ移行し、そこで炎症反応を引き起こした。また、投与部位の炎症反応について、同法では軽微であったのに対して、LNP を投与すると、炎症細胞の浸潤や壊死が観られた。
次に、モデル抗原を用いてワクチンとしての機能を検証しました。マウスを用いた「裸 mRNAワクチン」による抗体産生誘導は、ジェットインジェクターを用いることで飛躍的に向上し、最大許容用量における比較で、LNP に匹敵する効果が得られた。抗体は体内に侵入したウイルスを取り囲み感染予防に寄与するが、すでに感染してしまった細胞の駆逐には無力である。
そのような病的細胞を攻撃する免疫細胞の産生を促す細胞性免疫は、重症化予防に重要であるとされている。そこで、細胞性免疫の評価を行ったところ、「裸 mRNA ワクチン」の接種によりCD4陽性T細胞、CD8陽性T細胞といった免疫細胞が効率的に誘導されていることが確認できた。
さらに、新型コロナウイルス(SARS-CoV-2)のスパイクタンパク質を標的とした感染防御実験を行った。ここでは SARS-CoV-2 感受性を高めたマウスの肺に、SARS-CoV2 ウイルスを送り込み、発症する度合いを検討した。「裸mRNAワクチン」を事前に投与するとワクチン未接種マウスと比べて肺のウイルス量が有意に低くなることが実証され、組織学的評価においても肺炎が有意に軽減されることが示された。同様にカニクイザルにおいても、顕著な副反応を伴うことなくマウスに匹敵するワクチン効果が実証された。
メカニズムの解析も行った。【機能 II】に関連して、「裸 mRNA ワクチン」は投与した部位に留まり、リンパ節には移行しなかった。一方で、投与部位にてmRNAを取り込んだ抗原提示細胞がリンパ節に移行していることが観察され、これがワクチン効果に寄与したものと考えられる。
実際に、「裸mRNAワクチン」接種後に投与部位の所属リンパ節の成熟が観察された。また、【機能 III】に関連して、ジェットインジェクターが投与部位に限局した一過的な炎症を起因しリンパ球を呼び寄せることが分かった。注射器で mRNA を投与した群ではこのような炎症反応は観られなかっった。ジェ
ットインジェクターによる免疫刺激が、ワクチンの効果を高めるための「物理的アジュバント」として機能した可能性が示唆された。なお、この局所の炎症反応は数日以内に消失した。
これらの結果から、「裸mRNAワクチン」は、LNP で課題となっていた全身性の副反応を軽減し、感染症予防に必要な免疫を誘導できることが実証された。これは、mRNA 単体で感染症予防に成功した世界に先駆けた成果であり、実用的には、軽微な副反応がゆえに何度も接種可能なワクチンプラットフォームとなることが期待される。現在、2026年中の臨床試験入りを目指し、開発中である。


