武田薬品は27日、2022年度上期業績についてWeb説明会を開催し、クリストフ・ウェバー代表取締役社長CEOが、「上期のCore売上収益は恒常為替レート(CER)ベースで対前年同期+5.5%成長し、年度末に向けて力強いスタートを切った」と強調した。
上期末時点の純有利子負債/調整後 EBITDA 倍率は 2.6 倍に改善し、負債残高に占める固定金利負債の割合は約 98%、加重平均金利は約 2%となり、バランスの取れた満期償還プロファイルを示した。
ウェバー氏は、「当上期には、デング熱ワクチン QDENGAがインドネシアで初めて承認され、さらに最近、欧州およびデング熱流行国に対する欧州医薬品評価委員会(CHMP)の肯定的見解を受領するなど、いくつかの大きな事業目標に向けた節目を達成することができた」と説明。
その上で、「この成果と我々の業績は、当社の強固なパイプラインを前進させ、世界中の人々と患者さんに新たなソリューションを提供する能力を引き続き証明するものである」と総括した。
一方、コスタ・サルウコス武田薬品チーフ フィナンシャル オフィサーは、こうした好業績を踏まえた増配について、「純有利子負債 EBITDA 倍率は 2.6 倍に改善し、配当を増やしていくことに目を向けている」と話すに留めた。
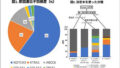
武田薬品の2022年度上半期業績は、売上収益1兆9748億円(対前年同期比10.1%増)、営業利益2550億円(同26.3%減)、当期純利益1668億円(同9.2%減)、EPS 108円(同8.1%減)となった。
売上収益の増収は、事業の好調な推移と為替相場が円安に推移したことによる増収影響が、前年同期に売上収益に計上した⽇本の糖尿病治療剤ポートフォリオの帝⼈ファーマ株式会社への譲渡価額1330億円の減収影響を上回ったことによるもの。
主要な疾患領域(消化器系疾患、希少疾患、血漿分画製剤(免疫疾患)、オンコロジー(がん)、およびニューロサイエンス(神経精神疾患))の売上収益は、前年同期から3156億円増収(+22.0%)の1兆7502億円となった。
潰瘍性大腸炎・クローン病治療薬「エンティビオ」(3466億円)、免疫グロブリン製剤(2451億円)、遺伝性血管性浮腫治療薬「タクザイロ」(728億円)など各疾患領域における好調な業績に加え、円安による増収影響により、オンコロジーを除き、それぞれ全社の売上収益の増収に貢献した。オンコロジーにおいては、一部の製品が後発品の参入や競争の激化による影響を受けた。
利益面は、前年同期に非定常的な売上収益として計上した帝人ファーマへの糖尿病治療薬4剤の譲渡額1330億円が当期は無くなったことが主要因となり減益となった。
新製品のEXKIVITYおよびLIVTENCITYは、順調な立ち上がりを見せ、さらなる市場成長および市場シェア拡大の可能性を反映した。
また、エンティビオについては、「バイオシミラーの参入は更新済みの時期の想定」、「IBDには引き続き高いアンメット・メディカル・ニーズの存在」などの要因により、ピーク時売上収益想定を75-90億米ドル(従来予想は55-65億米ドル)に引き上げた。
2023年度通期業績予想は、上半期の好調な業績を踏まえて、売上収益3兆9300億円(当初予想比2400億円増)、営業利益5300億円(同100億円増)、当期利益3070億円(同150億円増)、EPS198円(188円)に上方修正された。
2022年度上半期の主要5ビジネス領域に関する業績とパイプラインに関するアップデートのハイライトは次の通り。
【主要な5つのビジネス領域に関する業績アップデート】
2022年度上期の主要なビジネス領域の成長は、売上収益が7598 億円となり、CER ベースで 19%の成長となった成長製品・新製品に牽引された。
・ 消化器系疾患領域の財務ベース売上収益は 5,464 億円(CER ベース増減率:+12%)となった。これは、エンティビオの上期のグローバルでの売上が CERベースで 17%成長したため。この力強い業績とその他の要因により、エンティビオのピーク時売上収益想定を以前の55-65 億米ドルから75-90 億米ドルに上方修正した。
・ 希少疾患領域の財務ベース売上収益は 3,622 億円(CER ベース増減率:+8%)となった。遺伝性血管性浮腫治療剤であるタクザイロの力強い売上が牽引した。タクザイロの売上は予防薬市場の拡大、販売エリアの拡大、および投与患者数の増加が継続したため、CER ベースで対前年同期 31%の成長となった。
2021 年 12 月に米国で上市した LIVTENCITYは、全米の移植センターの 75%が少なくとも1人の患者に投与を開始しており、引き続き高い関心が寄せられ、投与患者数も増加している。
・ 血漿分画製剤(免疫疾患)領域の財務ベース売上収益は 3140 億円(CER ベース増減率:+14%)となった。免疫グロブリン製剤は、特に米国において供給量が増加している中で需要が増加し、CER ベースで17%の成長となり、アルブミン製剤は中国におけるロックダウンによる逆風があったもののCEベースで 8%の成長となった。
血漿分画製剤事業は、生命を脅かす疾患を有する患者さんに引き続き革新的な製品を創出し、供給している。
・ オンコロジー(がん)領域の財務ベース売上収益は 2253 億円となった。2022年5 月から米国で複数のベルケイドの後発品が参入し始めてきたため、CERベースで12%減少した。ベルケイドを除いた売上収益は2045億円(CERベース増減率:+6%)となった。
日本、欧州および成長新興国市場におけるアルンブリグや、患者アクセスおよびフロントライン適応での使用拡大により引き続き増加しているアドセトリス、さらには米国におけるアイクルシグに対する需要が増加した。
・ ニューロサイエンス(神経精神疾患)領域の財務ベース売上収益は 3023 億円(CER ベース増減率:+11%)となった。VYVANSE/ELVANSE(国内製品名:「ビバンセ」)は、米国における成人 ADHD 市場の拡大が牽引した。
トリンテリックスの売上収益は、米国における大うつ病(MDD)市場の回復が継続していることに加え、日本における力強い市場シェアの獲得により、498 億円(CER ベー ス増減率:+5%)となった。
【パイプラインに関するアップデート】
革新的なパイプラインの勢いを生かし、患者に新たな治療を届ける力を引き続き発揮することができた。2022年度第1四半期業績発表以降から現在までのアップデートは次の通り。
・ デング熱ワクチン候補である TAK-003 は、欧州およびデング熱流行国における4歳以上を接種対象と
して欧州医薬品庁(EMA)の欧州医薬品評価委員会(CHMP)による承認推奨を受けた。これは、欧州および EU-M4all制度に参加している欧州域外のデング熱流行国における医薬品使用に対するCHMP初の並行審査であった。
欧州における製造販売承認は今後数カ月以内となることが見込まれており、デング熱流行国であるラテンアメリカやアジア地域における規制当局による審査も進行中である
・ インドネシア国家医薬品食品管理庁は、デングウイルス感染歴を問わず6 歳から 45 歳を接種対象としてQDENGAを承認した。この承認は、武田薬品のデング熱ワクチン候補にとって初であり、同社が日本国外で初めて販売するワクチンである。
同承認は、アジアおよび中南米のデング熱流行地域に住む小児および若年層被験者2万人以上を対象に進行中のグローバルP3試験であるTIDES 試験の結果に基づくもの。
・ ファースト・イン・クラスの可能性があるセリアック病治療薬の開発について、提携・ライセンス契約を締結した。TAK-227は、重篤な自己免疫疾患であるセリアック病患者のグルテンに対する免疫反応を予防するよう開発されている。
現在、セリアック病を適応症として承認された治療薬はなく、セリアック病に関して3つのP2試験が進行中。
・ 米国FDAは、2歳以上12歳未満の小児患者を対象とした遺伝性血管性浮腫(HAE)の発作抑制に関するタクザイロの生物製剤承認一部変更申請を受理した。承認された場合、これは6歳未満のHAE患者を対象とした初めてかつ唯一の予防薬になる可能性がある。
・ EMAのCHMPは、移植後の、既存療法に抵抗性(抵抗性無しも含む)を示す難治性のサイトメガロウイルス(CMV)感染/感染症の成人患者さんを対象とした治療薬として、maribavir の承認を推奨した。
承認された場合、maribavir は欧州連合における初めてかつ唯一の CMV 特異的 UL97 プロテインキナーゼ阻害薬になる可能性がある。
・ 10月に20%皮下注用人免疫グロブリン製剤について、無又は低ガンマグロブリン血症を予定する効能効果として、厚生労働省に対し製造販売承認申請を行った。原発性免疫不全症候群(PID)や続発性免疫不全症候群(SID)と診断された成人及び小児患者における感染予防を目的として、30 カ国以上で承認され、CUVITRUの商標で使用されている。